서 론
아토피 피부염(atopic dermatitis, AD)은 자주 재발하는 만성 염증성 피부질환이다(Asher et al., 2006). 특히 최근 선진국에서 AD 발병률은 2–3배 증가하여 전 세계 어린이의 약 20%, 성인의 1%–3%에서 발생한다(Avena-Woods, 2017; Huang and Ong, 2018). 어느 신체 부위에서든 발생할 수 있으나, 주로 손과 발, 발목, 손목, 얼굴, 목 및 가슴에 자주 발생한다(Thestrup-Pedersen, 2000). AD는 수면을 크게 방해하는 등 삶의 질에 지대한 영향을 미칠 뿐 아니라, 매우 높은 의료 비용을 유발하기도 한다(Ali et al., 2020; Bawany et al., 2021). AD의 대표적인 증상은 지속적인 가려움이며, 부종, 건선증, 흥분, 홍반, 삼출, 미란 등이 동반되지만 이는 사람마다 다르다(Ellis et al., 2012). 많은 연구를 통해 AD의 원인이 면역 조절 장애와 피부 장벽 기능 장애라는 것은 밝혀졌지만, 아직 병태생리가 완전히 이해되고 있지는 않다(Kim et al., 2019). 특히 면역 조절과 관련하여 AD는 초기 또는 급성 단계에서 Th1, Th2 및 Th17 세포들로 인해 만성 단계로 발전하는 특징을 가지고 있다(Laughter et al., 2021). 또한 Th2 유래 사이토카인(cytokine)은 비만세포 같은 면역세포에 의해 방출되는 염증 매개체(e.g., immunoglobulin E, IgE)와 함께 피부의 염증을 더욱 악화시킨다(Fania et al., 2022).
일반적으로 자유 라디칼과 활성산소종(reactive oxygen species) 생성, 그리고 항산화 방어 기작 사이에 균형이 유지되지만, 이 균형이 무너지면 산화적 스트레스(oxidative stress)를 유발할 수 있다. 자유 라디칼은 세포막 파괴와 세포 손상의 주요 기전으로 여겨지는 지질 산화(lipid peroxidation)를 중재하며, 항산화 물질(antioxidants)은 자유 라디칼의 생성을 억제하는 물질이다(Dormandy, 1978; Sen, 1995; Sivaranjani et al., 2013). 이러한 산화적 스트레스와 무너진 항산화 방어 기작은 AD의 급성 악화와 관련이 있다고 보고된 바 있다(Sivaranjani et al., 2013; Tsukahara et al., 2003).
감(Diospyros kaki L.)은 Ebenaceae과에 속하며 한국, 중국, 일본 등 아시아 지역에서 널리 생산되고 있다(Direito et al., 2021). 감의 중요한 성분으로는 카로테노이드, 탄닌산, 페놀화합물, 프로안토시아니딘, 카테킨, 올레아놀릭산 등이 있으며, 산화적 스트레스, 고혈압, 당뇨, 죽상동맥경화증 등에 효과가 있다고 알려져 있다(Butt et al., 2015). 본 연구진은 이미 감 1,3-butylene glycol 추출물(butylene glycol extract, DBG) 및 ethanol 추출물(ethanol extract, DET)의 항산화, 항노화 및 미백 기능을 규명하였다(Hong and Lyu, 2022). 본 연구에서는 감 1,3-butylene glycol 및 ethanol 추출물들의 아토피 관련 사이토카인(IL-2, IL-8, TNF-α) 및 IgE 조절 기능을 알아보고, 이에 더해 항산화 효소인 superoxide dismutase(SOD) 활성 증가로 인한 항산화 작용도 함께 알아보고자 한다.
재료 및 방법
감은 청도군(Korea)에서 재배된 청도반시를 구입하여 사용하였다. 감을 씻은 후 70% EtOH로 소독하고 건조하였다. 소독된 감 100 g을 직경 1×1 cm로 자른 후 1,3-butylene glycol과 ethanol로 각각 추출하였다. 감 1,3-butylene glycol 추출물(DBG)의 경우 400 g의 1,3-butylene glycol과 distilled water(D.W.) 600 g을 넣고 7일간 상온에서 침지시켰다. 감 ethanol 추출물(DET)의 경우 1,000 g의 ethanol을 넣은 후 48시간 동안 상온에서 침지시켰다. 이후 두 추출물들을 400 mesh filter로 filter하고 0.45 μm 필터로 다시 한 번 filter한 후 사용하였다. 최종 회수한 원료의 건조 잔량은 0.87%(DBG)와 5.52%(DET)였다.
사람 각질형성세포인 HaCaT, 사람 B세포인 U266B1, 그리고 사람 상피세포인 Caco-2는 America Type Culture Collection (ATCC, University Blvd., Manassas, VA, USA)에서 분양받아 사용하였으며, 사람 단핵구 세포인 THP-1와 사람 T 세포인 Jurkat은 한국세포주은행(Seoul, Korea)에서 분양받아 사용하였다. HaCaT 세포는 10% fetal bovine serum(FBS; GibcoBRL, Grandsland, NY, USA), 1% penicillin/streptomycin(GibcoBRL)이 첨가된 Dulbecco’s modified Eagle’s medium(DMEM; GibcoBRL) 배지로 배양하였다. Caco-2 세포는 10% FBS, 1% penicillin/ streptomycin이 첨가된 Eagle’s minimum essential medium (EMEM; GibcoBRL) 배지로 배양했으며, U266B1, THP-1, Jurkat 세포는 10% FBS, 1% penicillin/streptomycin이 첨가된 RPMI-1640(GibcoBRL) 배지를 사용하였다. 모든 세포는 CO2 incubator(Sanyo, Tokyo, Japan; 5% CO2, 95% air, 37°C)에서 배양하였다. 세포 생존율을 측정하기 위하여 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolim bromide(MTT) assay를 사용하였다. 96-Well plate(Thermo Fisher Scientific, Rochester, NY, USA)에 1×104 cells/well씩 seeding한 후 감 추출물을 다양한 농도로 200 μL씩 분주하여 48시간 배양하였다. 이후 well에 MTT solution(3 mg/mL; Sigma-Aldrich, St. Louis, MO, USA)을 50 μL씩 넣고 incubator에서 4시간 동안 반응시켰다. 상등액을 제거한 뒤 dimethylsulfoxide를 150 μL씩 넣고 570 nm에서 흡광도를 측정하였다.
Jurkat 세포는 10 pg/mL의 lipopolysaccharide(LPS)와 5 μg/mL의 phytohemagglutinin, 10 ng/mL phorbol myristate acetate (PMA)로 IL-2 분비를 유도하였다. THP-1 세포는 50 ng/mL PMA로 분화(differentiaton)를 유도한 뒤, 100 ng/mL LPS로 자극시켜 IL-8 분비를 유도하였으며, U266B1 세포는 4 μg/mL LPS와 100 U/mL IL-4로 자극시켜 IgE 분비를 유도하였다. 그 밖에 Caco-2와 HaCaT 세포는 100 ng/mL LPS로 자극시켜 IL-8 분비를 유도하였다. 이후 다양한 농도로 감 추출물을 처리한 뒤 모든 세포는 48시간 동안 CO2 incubator(5% CO2, 95% air, 37°C)에서 배양하였다. 배양 후 상등액만 모아 사이토카인 분비 변화를 측정하였다.
SOD 활성은 pyrogallol의 자가 산화를 저해하는 정도를 측정하였다. 1 mM diethylenetriamine pentaacetic acid가 포함된 50 mM Tris-HCl buffer(pH 8.2)에 0.2 mM pyrogallol을 넣고 420 nm에서 3분 동안 흡광도 변화를 측정하였다.
사이토카인 분비 변화를 측정하기 위하여 enzyme-linked immunosorbent assay(ELISA) 세트(IL-2, IL-8, TNF-α, IgE)는 BD Biosciences(Franklin Lakes, NJ, USA)에서 구입하였다. Capture antibody를 coating buffer(0.1 M sodium carbonate, pH 9.5)에 희석하여 96-well plate에 분주한 후 4°C에서 24시간 두었다. Plate를 PBS/Tween-20으로 3회 세척한 후 1% bovine serum albumin으로 blocking한 후 상온에서 1시간 동안 방치하였다. PBS/Tween-20으로 3회 세척 후 standard와 샘플을 분주하고 2시간 동안 상온에서 방치하였다. 다시 PBS/Tween-20으로 5회 세척하고 detection antibody와 streptavidin-horseradish peroxidase를 mix하여 분주한 후 1시간 동안 상온에 방치하였다. 마지막으로 PBS/Tween-20으로 5회 세척 후 TMB substrate reagent(BD Biosciences)를 분주한 후 상온에서 30분 방치하였다. 이후 stop solution(1 M phosphoric acid)으로 반응을 정지시킨 후 450 nm에서 흡광도를 측정하였다.
결과 및 고찰
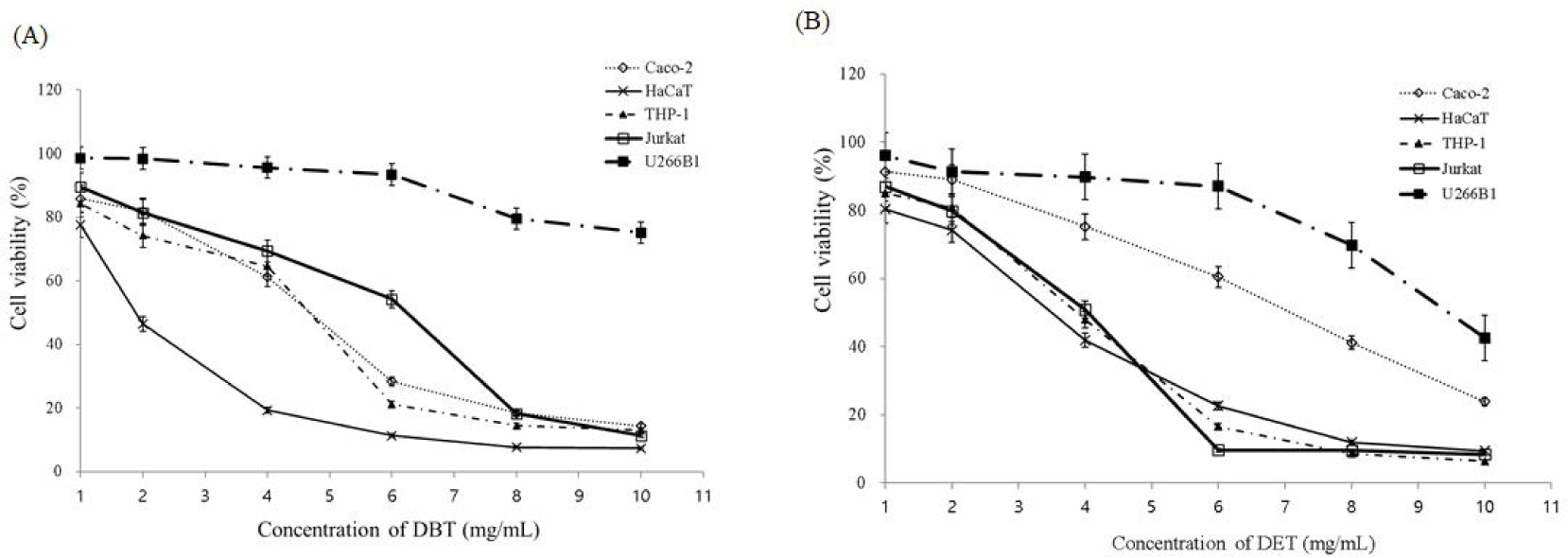
감 추출물이 세포 독성에 미치는 영향을 알아보기 위하여 MTT assay를 수행하였다. 우선 Caco-2, HaCaT, THP-1, Jurkat, U266B1 세포에 각각 감 추출물인 DBG와 DET 추출물을 농도별로 처리하고 48시간 동안 37°C에서 CO2 incubator에 배양하여 세포 생존율을 확인하였다. 그 결과 두 추출물 모두 1 mg/mL에서 세포들에 대하여 80% 이상의 생존율을 보여, 추후 실험은 상기 농도 이하로 진행하였다(Fig. 1).
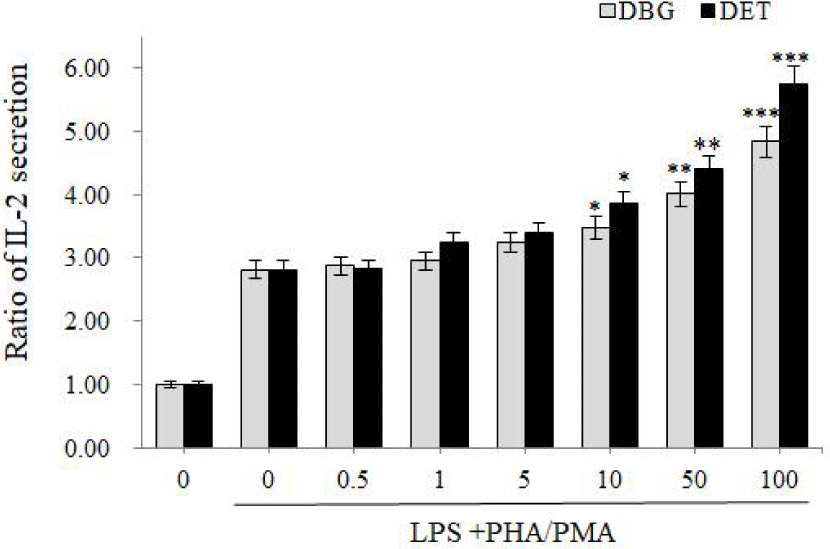
AD의 면역학적 특징은 Th1/Th2의 균형이 무너진 것이다. Th2가 우세하게 되면 꽃가루, 집먼지 진드기와 같은 환경 알레르겐에 대한 반응, IgE 생성 및 호산구 과립 세포의 활성화가 나타난다(Lugović et al., 2005). Th2 사이토카인 중 하나인 IL-4는 IgE 합성을 유도하며, Th1 세포 생성을 억제한다(Leung and Bieber, 2003). Th1 세포의 활성이 억제되므로 Th1 사이토카인인 IL-2, IFN-γ는 감소하게 되는 반면, Th2 사이토카인인 IL-4, IL-5, IL-6 등은 더욱 증가하게 된다(Baek et al., 2007). 실제로 AD 환자들의 말초혈액단핵구를 조사한 결과, 비환자군인 대조군에 비해 IL-2 생산량이 유의성 있게 낮았다(Takahashi et al., 1992). 본 실험에서는 감 1,3-butylene glycol 추출물인 DBG와 감 ethanol 추출물인 DET를 사람 T-세포(Jurkat cell)에 처리하니 10–100 μg/mL의 농도에서 DBG와 DET 모두 IL-2 분비량을 현저하게 증가시켰다. 특히 100 μg/mL에서 대조군에 비해 DBG는 4.83배, DET는 5.73배 IL-2의 분비량을 증가시켰다. 이는 감 추출물이 AD의 세포면역반응에서 Th1 반응을 증가시킬 수 있다고 볼 수 있다(Fig. 2). 다만 AD에서는 T세포 분극(polarization)이 이중상(biphasic)으로 나타나서, 급성기인 경우 Th2가 우세하지만 만성기로 갈수록 Th1 반응이 우세해지므로(Brandt and Sivaprasad, 2011; Meagher et al., 2002), 만성기에서는 사용을 조심해야 할 것으로 사료된다.
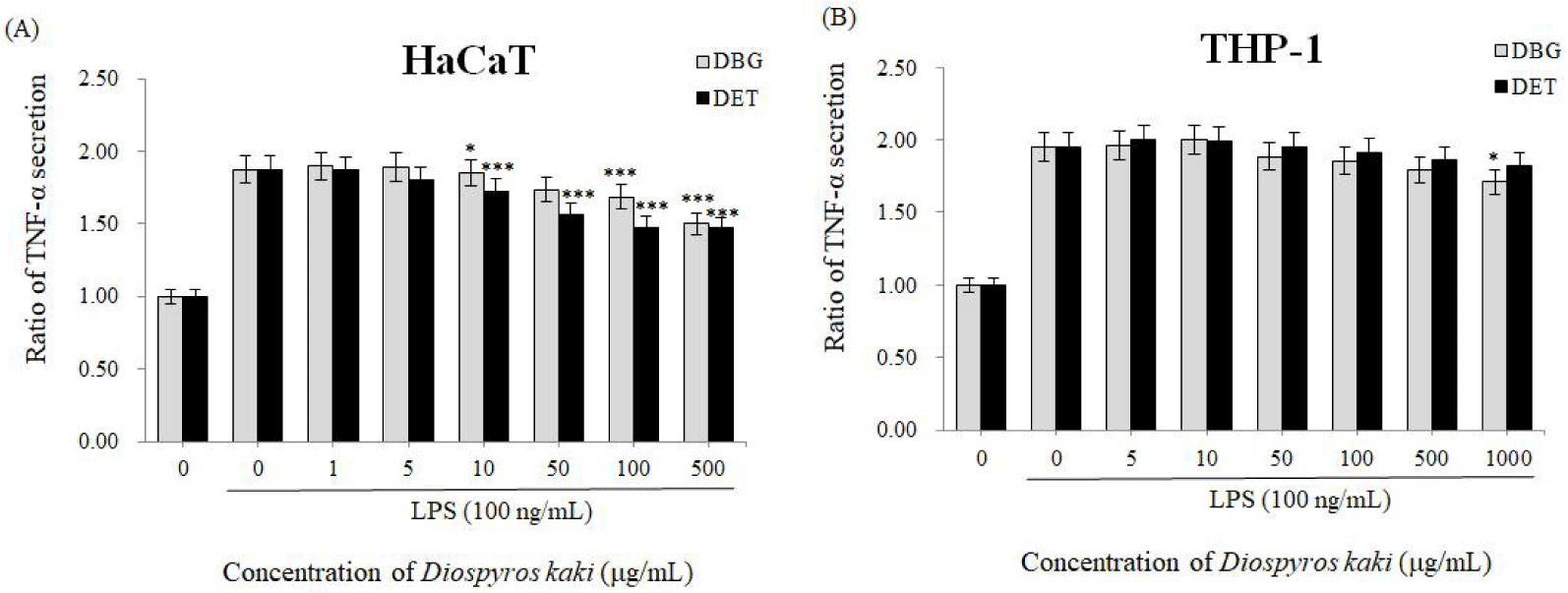
AD 초기 단계에서 피부 각질세포는 기계적인 손상과 피부 장벽 파괴 후 사이토카인과 케모카인이 생성된다(Novak and Leung, 2011). 이는 염증 반응이 시작되는 초기 단계로서 가려움증을 일으킨다(Bieber, 2010). 이후 각질세포는 IL-1, TNF-α, IL-8, CCL2/MCP-1 등을 생산하기 시작하고, 이로 인해 AD의 특징적인 임상 및 조직학적 모습이 나타나기 시작한다(Wüthrich and Schmid-Grendelmeier, 2003). 특히 TNF-α는 다양한 염증성 질환에서 해로운 역할을 하는 것으로 보고되어 있다(Wu and Siegel, 2011). 각질세포와 섬유아세포에서 TNF-α, IL-8, CXCL10 등의 분비량이 증가하면 이는 IL-17 증가로 이어져서 염증성 반응이 유도된다(Eyerich et al., 2009). 현재까지 건선과 같은 자가면역 염증성 질환에 대한 항-TNF 치료법이 임상에서 개발되었으며, 이러한 환자들에게 효과적임이 입증되었다(Bouguen et al., 2020; Guilloteau et al., 2010). 본 실험에서는 감 추출물을 사람 각질형성세포인 HaCaT 및 사람 T 세포인 THP-1에 처리한 뒤 TNF-α 생성량을 ELISA를 통해 확인하였다. 그 결과, 양성 대조군에 비해 두 감 추출물 모두에서 TNF-α 생성량이 유의성 있게 감소하였다. 특히 10 μg/mL 이상의 농도에서 DBG와 DET는 HaCaT 세포에서 TNF-α의 분비량을 현저히 감소시킬 수 있었으며, 1,000 μg/mL의 농도에서는 TNF-α의 분비량을 DBG가 23.4%, DET가 24.8%씩 억제하였다(Fig. 3A). 반면 THP-1 세포에서는 1,000 μg/mL의 DBG만이 TNF-α의 분비량을 12.4% 감소시켰다(Fig. 3B). 그러므로 감 추출물, 특히 1,3-butylene glycol 추출물이 TNF-α 분비를 억제하여 TNF-α 유도로 인한 피부 장벽 기능 붕괴로부터 각질형성세포, 상피 세포 등을 보호할 수 있으리라 예상되며, TNF-α에 의해 매개되는 기타 염증성 질환도 완화시킬 수 있으리라 기대된다.
AD에 있어서 또 하나의 중요한 biomarker는 IgE이다. 특정 항원에 대한 IgE는 mast cell 등과 결합하고 있다가 동일한 항원에 다시 노출되면 histamine 등을 유리하여 AD를 발생시킨다(Sada et al., 2000). 일반적으로 혈중 IgE 농도는 AD 환자에게서 증가되어 있다(Meagher et al., 2002). AD 환자의 말초혈액단핵구를 살펴보면 IFN-γ 생산능력이 감소되어 있으며, 이는 혈청 IgE와 역상관 관계에 있다. 알레르겐에 대한 IgE 민감성 정도는 아토피 피부염의 심각 정도와 직접적으로 관련이 있다(Leung and Bieber, 2003). 감 추출물인 DBG와 DET를 사람 B 세포(U266B1 cells)에 처리하고 ELISA를 이용하여 IgE의 분비량을 살펴본 결과, 두 실험군에서 모두 IgE 분비가 유의성 있게 감소하였다. 특히 사이토카인 결과와 비교해 볼 때, 매우 낮은 농도(1 μg/mL)에서도 유의성 있게 IgE 분비를 억제할 수 있었으며, 최고 농도인 100 μg/mL에서 DBG는 34.6%, DET는 26.0%씩 IgE 분비를 억제하였다(Fig. 4).
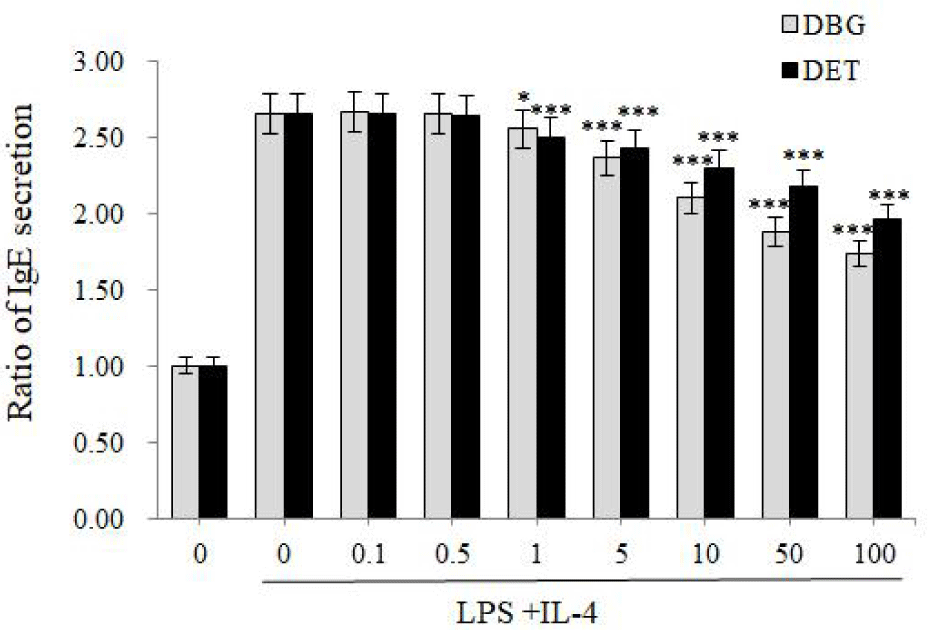
IgE는 특히 알레르기성 질환 초기에 혈액 내에서 농도가 증가하므로(Leung et al., 2004), 감 추출물은 급성 AD 초기에 효과가 좋을 것으로 생각된다.
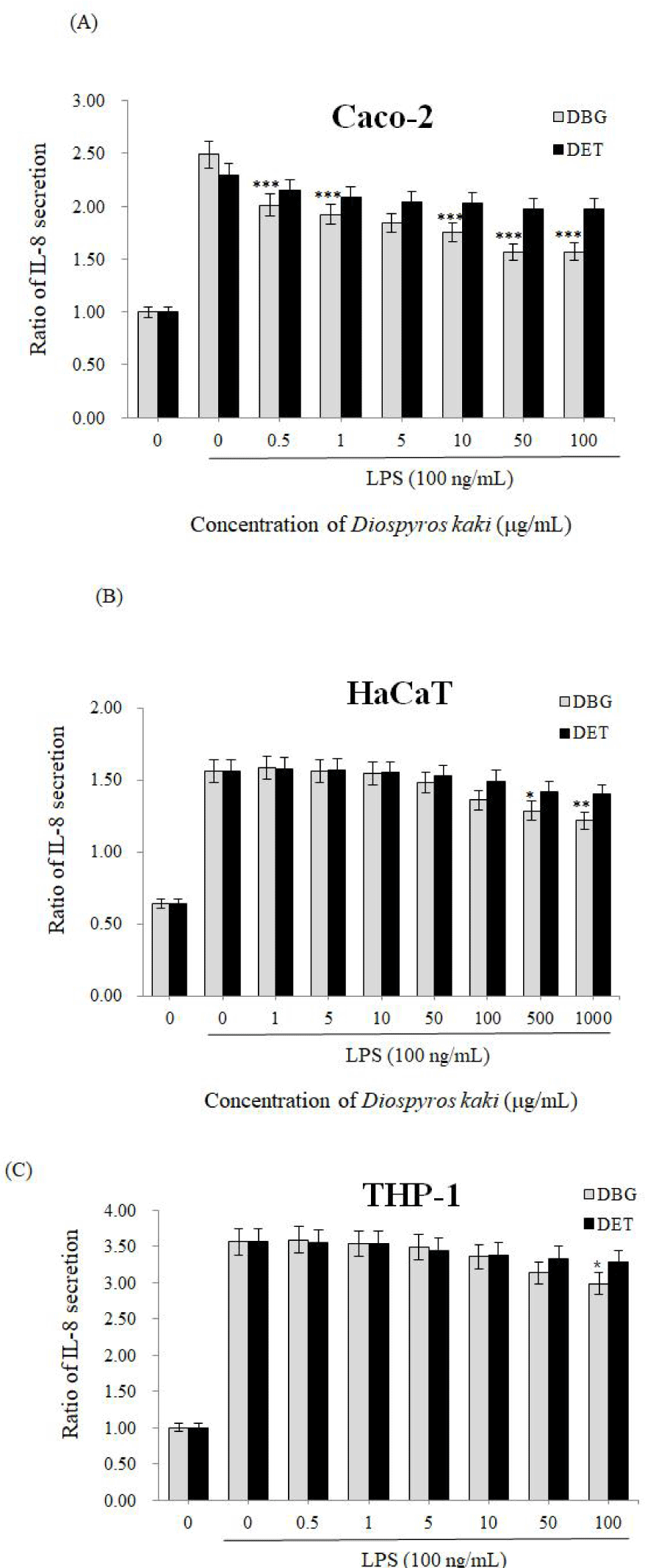
또한 이와 관련하여, 집먼지 진드기(Dermatophagoides pteronissinus)는 AD, 천식, 비염 등을 일으키는 주요 원인이며, AD 환자가 D. pteronissinus에 노출되면 특이적인 IgE가 증가한다고 한다. 이러한 AD를 유발하는 D. pteronissinus가 사람 호흡기 상피세포 및 T 세포에서 IL-8 분비를 증가시킨다고 알려져 있다(Lee et al., 2008; Sohn et al., 2007; Ziyaei et al., 2017). 본 실험에서는 사람 상피세포(Caco-2 cells), 각질세포(HaCaT cells), 그리고 T-세포(Jurkat cells)에 감 추출물인 DBG, DET를 처리하고 IL-8 분비량을 ELISA를 통해 조사하였다. 그 결과, DBG는 사람의 상피세포, 각질형성세포, 단핵구에서 모두 IL-8의 분비를 현저히 감소시킬 수 있었으며, 특히 사람 상피세포인 Caco-2에서 최고 37.0%까지 IL-8 분비를 억제할 수 있었다(Fig. 5). 반면, DET는 상기 세포들에서 IL-8 분비를 유의성 있게 억제시키지 못했다. 이 결과는 감 1,3-butylene glycol 추출물이 ethanol 추출물보다 우수한 효과를 보인 본 연구진의 과거 연구(Hong and Lyu, 2022)와 비교적 일치하기도 한다. 차나무(Camellia sinensis) 1,3-butylene glycol 추출물의 경우, ethanol 추출물보다 생리활성 물질(bioactive component) 함량이 더 높았으며, 이로 인해 ethanol 추출물보다 항산화 활성 등이 더 높은 것으로 보고되어 있다(Myo et al., 2023). 그러므로, DBG와 DET의 항염증 활성 차이는 각각의 추출물에 함유되어 있는 생리활성 물질의 차이로 기인하는 것으로 생각되며, 이에 대한 후속 연구가 필요하다. 결론적으로, 감 추출물, 특히 1,3-butylene glycol 추출물은 IgE의 분비를 억제시키고, 이는 IL-8의 분비 억제로 이어져 AD를 개선시킬 수 있으리라 사료된다.
많은 연구들을 통해 산화적 스트레스가 아토피 피부염과 관련이 있다는 것이 알려져 있다(Wüthrich and Schmid-Grendelmeier, 2003). 손상된 산소/질소 라디칼 항상성과 증가된 산화적 스트레스가 소아 AD의 병태생리학적 원인으로 지목되고 있으며, AD가 있는 유치원생들과 대조군을 비교해보았을 때 혈액 항산화 능력이 현저하게 떨어진다고 보고되어 있다(Chung et al., 2009). 최근에는 대조군과 비교했을 때 습진 환자군 혈청 속의 비타민 A, C 및 E와 같은 항산화 물질의 농도가 낮다는 것을 발견했다(Amin et al., 2015). 또한 AD와 밀접한 관련이 있는 염증성 피부 질환인 탈모 환자에서도 산화적 스트레스 증가가 보고되었다(Bakry et al., 2014; Mohan and Silverberg, 2015). 산화적 스트레스는 항산화 효소의 유전자 발현을 활성화하기 위해 NF-κB 경로를 활성화할 수 있음이 알려져 있다. 그러나 NF-κB 경로가 활성화되면 IL-6, IL-8 및 IL-9 같은 염증성 사이토카인의 발현이 유도되어 이로 인해 피부 염증이 악화될 수 있다(Koren Carmi et al., 2015; Kruk and Duchnik, 2014; Wullaert et al., 2011; Yao et al., 2011). 또한 산화적 스트레스는 피부 표피 각질세포에서 DNA 손상, 세포 효소 손상, 지질 산화를 통한 세포막 구조 손상 등을 일으킬 수 있다(Ichiishi et al., 2016).
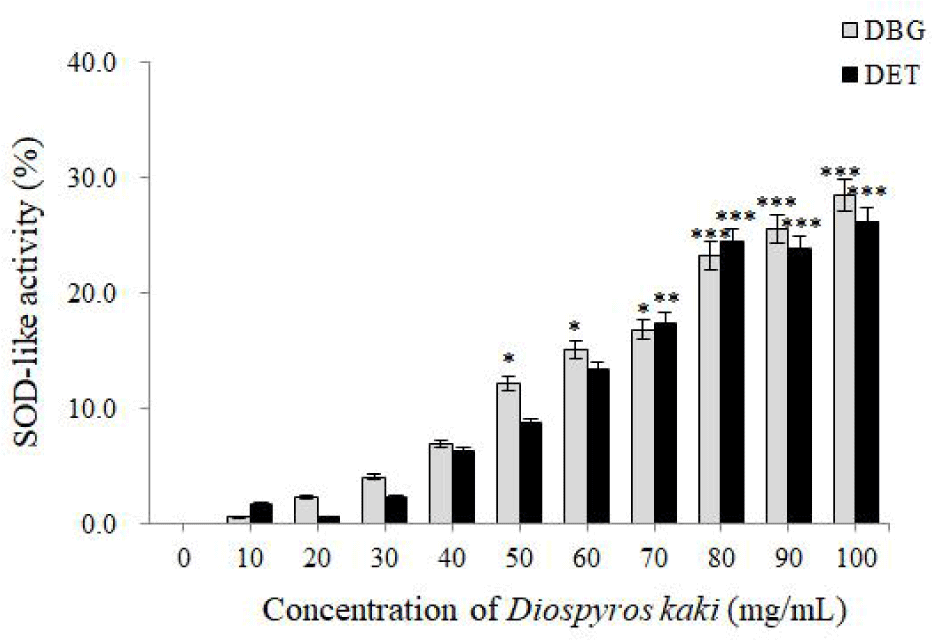
본 실험에서는 감 추출물 두 종류가 SOD의 효소 활성도를 현저히 증가시킴을 확인할 수 있었다. 특히 음성 대조군에 비해 100 mg/mL DBG는 SOD-유사활성을 28.5% 증가시켰으며, 동일 농도에서 DET는 26.2% 증가시켰다(Fig. 6). 생체 내 활성산소가 방어기작인 SOD, catalase, glutathione peroxidase 등의 항산화효소 등에 의해 제거되므로(Cassatella et al., 1989), 감 추출물이 SOD 활성도를 증가시켜 AD의 증상을 완화시킬 수도 있다고 사료된다.