서 론
최근 소비자들의 건강에 관한 관심이 증가함에 따라 식품 시장에서도 안전성 및 기능성을 강화한 신제품 개발이 지속되고 있다(Jeong et al., 2023). Park 등(2019)의 연구에서 소비자들은 식품 선택 시 제품의 영양적 품질과 함께 안전성을 중요시하는 것으로 보고되었으며, 이러한 추세에 따라 합성 식품 첨가물 이용에 대한 거부감이 증가하고 있다(Yong et al., 2020).
식육 가공품은 고품질 단백질 식품으로 식육을 주 원료로 하여 다양한 부재료 및 식품첨가물을 이용하여 제조된다(Jo et al., 2018). 식육 가공품 제조에 이용되는 다양한 식품 첨가물들은 식육 가공품의 미생물학적 안전성 확보 및 관능적 품질 향상에 필수적인 역할을 하지만, 식품 첨가물 이용에 대한 소비자들의 부정적 인식 개선을 위해 보다 소비자 친화적인 천연물의 이용 및 가공기술 개발이 요구되고 있다(Jo et al., 2020).
인산염은 산도조절제로 구분되는 첨가물로 식육 가공품에 첨가시 pH 증가에 의해 보수력을 증진하여 제품에 다즙성 개선과 함께 수율을 증진시킨다(Kim et al., 2017). 또한 인산염은 금속이온과 결합함에 따라 지방과 단백질의 산화를 억제할 뿐 아니라 칼슘 이온과 마그네슘 이온을 불활성화 함으로써 actomyosin을 해리하는 효과가 있다(Jiménez-Colmenero et al., 2001; Long et al., 2011). 사후 근육에서 myosin과 actin 사이 가교 결합에 의해 형성된 actomyosin의 해리는 myosin과 actin의 용해도를 증가하여 식육 가공품 제작 시 유화력과 결착력을 증진시킨다(Jeong et al., 2023). 인산염을 대체하기 위한 다수의 연구들이 진행되었으며(Cao et al., 2022; Wang et al., 2023), 팽이버섯 분말을 이용해 인산염의 pH 증가 및 보수력 증진 기능이 대체가 가능함이 보고되었다(Jeong et al., 2023). 그러나, 인산염의 actomyosin 해리 기능을 대체할 수 있는 천연물 또는 가공기술 개발이 아직은 부족한 실정이다.
초고압 처리는 비가열 살균 기술 중 하나로 식품 산업에서 널리 이용되고 있다(Simonin et al., 2012). 또한 기존 연구에 따르면 식육에 초고압 처리 시 단백질의 구조에 영향을 미침을 보고하였는데, 100–300 MPa 초고압 처리 시 식육 내 actomyosin이 해리됨에 따라 근원섬유 단백질의 용해도 증가가 가능하다고 보고되었다(Bajovic et al., 2012). 하지만 높은 압력에서 초고압 처리 시 발생하는 단백질의 과도한 변성으로 오히려 식육 품질에 부정적인 영향을 미칠 수 있으며, 일반적으로 식육의 가공 적성 향상을 위해 200 MPa 처리가 최적 조건으로 보고되고 있다(Yang et al., 2021a; Zhang et al., 2017).
따라서 본 연구는 초고압 처리가 돈육의 가공적성에 미치는 영향을 평가하고 초고압 처리된 돈육을 이용한 유화형 소시지 내 인산염 대체 가능성을 평가하기 위해 수행되었다.
재료 및 방법
도축 24시간 후 3개의 돼지 우측 도체에서 뒷다리의 대퇴이두근(bicep femoris)을 정형하여 본 연구에 이용하였으며, 근육을 반으로 나누어 초고압 처리구와 대조구로 구분한 후 진공포장(DWC-160, Duckwoo Machinery, Jangseon, Korea)하였다. 진공 포장된 근육의 초고압 처리는 200 MPa로 3분간(Uhde 055-60, thyssenkrupp Industrial Solutions, Dortmund, Germany) 처리하였으며, 초고압 처리시 실린더 내부 온도는 21℃였다.
돈육 2 g에 20 mM potassium phosphate buffer(pH 7.0)에 용해한 50 mM KCl 10 mL를 첨가한 후, 균질기(T25 basic)를 이용하여 13,000 rpm에서 15초간 균질하였다. 균질물은 3,000×g에서 10분간 원심분리(1580R)하여 상등액을 제거하였다. 이후 침전물에 동일 buffer를 첨가한 후 균질 및 원심분리 과정을 2회 추가 반복하였다. 상등액을 제거한 침전물에 다시 20 mM potassium phosphate buffer에 용해된 0.6 M KCl 20 mL를 첨가하여 위의 조건과 동일하게 균질과 원심분리를 진행하였다. 상등액은 1.0 mm의 mesh strainer에 여과한 후 20 mM phosphate buffer 30 mL를 첨가하고, 30분간 4℃에서 혼합하였다. 혼합물은 3,000×g에서 10분간 원심분리(1580R)하여 상등액을 제거한 침전물에 20 mM potassium phosphate buffer(pH 7.0)에 용해한 50 mM KCl를 첨가하여 균질 및 원심분리(3,000×g, 10분, 1580R) 후 최종 침전물에 0.1 M potassium phosphate(pH 7.4)를 첨가하여 actomyosin 추출물로 이용하였다. 추출물의 단백질 함량은 Bio-Rad assay kit(#5000006, Bio-Rad Labs., Richmond, CA, USA)를 이용해 측정하고, 표준 곡선은 bovine serum albumin을 이용해 제작하였다.
총 단백질 용해도 측정을 위하여 돈육 1 g을 0.55 M potassium iodide가 용해된 0.05 M potassium phosphate buffer(pH 7.4) 20 mL과 혼합하였으며, 근장 단백질 용해도 측정을 위해 돈육 2 g을 0.03 M potassium phosphate(pH 7.4) 20 mL과 혼합 후 13,000 rpm에서 30초간 균질하였다(T25 basic). 균질물은 4℃에서 24시간 동안 교반 후(OS-2000, Jeio Tech., Daejeon, Korea) 원심분리(3,000×g, 10분, 1580R) 하였으며, 상등액을 여과(No. 4 filter paper, Whatman, Maidstone, UK) 하였다. 여과물의 단백질 함량은 Bio-Rad assay kit(#5000006)를 이용해 측정하고 근원섬유 단백질의 용해도 측정은 총 단백질 용해도에서 근장 단백질 용해도를 제한 값으로 계산하였다.
돈육으로부터 근원섬유 단백질 추출은 Lee 등(2020)의 방법을 참고하여 진행하였다. 돈육 1 g에 25 mL의 냉각된 버퍼(2 mM MgCl2, 0.1 M KCl, 1 mM EGTA, 10 mM potassium phosphate, pH 7.0)를 첨가한 후 15초간 두 번 균질하였다(T25 basis). 균질된 시료를 10분간 4℃에서 12,000 rpm으로 원심분리하였다(1580R). 추출된 침전물에 동일한 버퍼를 20 mL씩 두 번 첨가 및 혼합한 후 원심분리하여(1580R) 상등액을 제거하였으며, 침전물은 100 mM NaCl 20 mL를 이용하여 세 번 washing한 후 마지막 침전물을 0.1 M potassium phosphate(pH 7.4)로 용해시켰다.
Sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE)는 30% acrylamide, 0.5 M Tris-HCl(pH 6.8), 1.5 M Tris-HCl(pH 8.8), 10% ammonium persulfate 및 N,N,N’,N’-tetramethyl-ethylenediamine을 함유한 12.5%의 polyacrylamide 겔을 이용하여 진행하였다. 근원섬유 단백질 추출물과 sample buffer(125 mM Tri분석한 후, 2차 구조의 함량s-HCl, 20% glycerol, 2% SDS, 2% mercaptoethanol, 0.02% bromophenol blue)를 1:1(w/w)로 혼합한 뒤 95℃의 heating block에서 가열하였다. 전기영동은 겔에 10 μg (74.7 μg protein)의 시료와 5 μg의 pre-stained protein ladder (3454A, Takara Bio, Shiga, Japan)를 로딩한 후 running buffer (0.1% SDS, 25 mM Tris, 192 mM glycine)을 이용하여 pagerRun 장치(AE-6531 mPAGE, ATTO, Tokyo, Japan)로 20 mA에서 120분간 진행하였다. 겔 내 단백질들을 Coomassie brilliant blue와 10% acetic acid 용액으로 염색한 후 스캔하여(GS-710, Bio-Rad Laboratories, Hercules, CA, USA) Image Master 2D Platinum v5.0(GE Healthcare, formerly Amersham Biosciences, Seoul, Korea)를 통해 각 단백질 밴드의 강도를 분석하였다.
Myosin의 구조 측정을 위해 Fu 등(2020)의 방법을 이용하여 myosin을 추출하였다. 돈육 1 g에 2 mM MgCl2와 1 mM ethylene glycol tetraacetic acid(EGTA) 및 0.1 M KCl을 용해한 10 mM potassium phosphate(pH 7.0) 10 mL을 첨가 및 균질한 후(T25 basic) 2,000×g에서 10분간 원심분리하였다(1580R). 이후 Tris 버퍼(5 mM tris, 1 mM EGTA, 1 mM 1,4-dithiothreitol (DTT), pH 7.8) 5 mL을 침전물에 첨가한 후 이전 과정과 동일한 조건에서 균질 및 원심분리한 후 침전물에 150 mM ethylenediaminetetraacetic acid(EDTA)을 용해한 150 mM potassium phosphate(pH 6.5) 15 mL를 첨가하여 다시 균질 및 원심분리하였다. 이후 침전물에 G-S 버퍼(0.4 M NaCl, 5 mM MgCl2, 5 mM Na4P2O7, 150 mM Na3PO4, pH 6.0)를 15 mL 첨가한 후 20분간 원심분리(1580R)하여 상등액을 1.0 mm mesh strainer에 여과하였다. 여과액에 20 mL의 증류수를 혼합하여 10분간 원심분리하고, 침전물에 0.6 M의 KCl을 용해한 40 mM potassium phosphate buffer(pH 6.5)를 첨가하였다. 혼합물의 단백질 함량은 Bio-Rad assay kit(#5000006)를 이용하여 측정하였다.
Myosin의 2차 구조 측정을 위해 myosin 추출물(단백질 함량 0.5 mg/mL)의 원편광 이색성(circular dichroism, CD) 스펙트럼은 CD 분광기(Chirascan, Applied Photophysics, Surrey, UK)를 이용해 측정하였다. 시료는 1.0 mm optical path length의 석영 큐벳을 이용해 200–260 nm의 파장에서 대역폭을 1 nm으로 설정하여 분석한 후, 2차 구조의 함량(α-helix, β-sheet, β-turn, random coil)을 CDNN 소프트웨어를 통해 계산하였다.
Myosin의 3차 구조 변화 측정을 위해 myosin 추출물의 표면 소수성 및 총 free sulfhydryl 그룹 함량을 측정하였다. Myosin 추출물(단백질 함량 1 mg/mL)의 표면 소수성을 측정하기 위하여 bromolphenol blue(BPB)와 결합한 양을 이용하였다. BPB 용액(1 mg/mL) 200 μg를 시료 1 mL에 첨가한 후 혼합하고, 대조구 시료에는 0.1 M potassium phosphate 버퍼(pH 7.4) 1 mL에 200 μg의 BPB를 첨가하여 제작하였다. 시료를 10분간 실온에서 정치한 후 15분간 2,000×g에서 원심분리하였다. 원심분리 후 추출된 상등액을 10배 희석한 후 595 nm에서 흡광도 측정(Varioskan LUX)을 진행하였다. BPB와 결합된 함량은 아래와 같이 계산하였다.
Myosin의 총 free sulfhydryl 그룹 함량 측정을 위해 myosin 추출물(단백질 함량 1 mg/mL) 0.5 mL에 8 M urea 2 mL와 0.5 mL의 10 mM 5,5′-dithiobis(2-nitrobenzoic acid) 용액을 첨가 후 15분간 25℃에서 정치하였다. 혼합물의 흡광도는 plate reader(Varioskan LUX)를 통해 412 nm에서 측정하였고, 총 free sulfhydryl 그룹 함량은 11,400 M–1 cm–1의 몰 흡광계수를 통해 계산하였다.
단백질 산패도를 확인하기 위해 protein carbonyl 함량을 Estévez(2011)의 방법을 이용하여 측정하였다. 돈육 1 g에 0.6 M NaCl을 용해한 20 mM sodium phosphate(pH 6.5) 버퍼 10 mL을 첨가하여 13,000 rpm으로 30초간 균질하였다(T25 basic). 균질물 0.2 mL을 각각 microtube에 옮겨 담은 후 각 tube에 10% TCA를 1 mL 첨가한 후 620×g에서 원심분리를 5분간 진행하고(1580R) 상등액을 제거하였다. 침전물은 단백질 함량과 carbonyl 함량 측정을 위한 시료로 이용하였다.
단백질 함량을 측정하기 위하여 침전물에 2 M HCl을 1 mL을 첨가한 후 실온에서 1시간 반응시켰다. 혼합물에 10% TCA를 1 mL 첨가 후 620×g에서 5분간 원심분리하였다(1580R). 원심분리 침전물에 6 M guanidine HCl을 용해한 20 mM sodium phosphate(pH 6.5)를 2 mL 첨가하여 침전물을 용해시킨 후 Bio-Rad assay kit(#5000006)를 이용하여 단백질 함량을 측정하였다(Varioskan LUX). Carbonyl 함량을 측정하기 위하여 침전물에 0.2% dinitrophenylhydrazine(DNPH) 1 mL을 첨가한 후 실온에서 1시간 정치한 후 10% TCA를 1 mL 첨가하여 620×g에서 5분간 원심분리하였다(1580R). 상등액 제거 후 침전물에 ethanol과 ethyl acetate 혼합액(1:1, v/v)을 1 mL 첨가한 후 30초간 혼합 및 원심분리한 후 상등액을 제거하는 과정을 두 번 반복하였다. 이후 침전물 6 M guanidine HCl을 용해한 20 mM sodium phosphate(pH 6.5)를 2 mL 첨가한 뒤 혼합하고 370 nm에서 흡광도를 측정하였다(Varioskan LUX). 이후 carbonyl 함량의 계산은 22,000 M–1cm–1의 몰 흡광계수를 이용하였으며, 최종 protein carbonyl 함량은 nmol/mg으로 나타내었다.
지질 산패도 측정을 위하여 지질 산화 2차 생성물인 malondialdehyde 함량을 thiobarbituric acid reactive substance(TBARS) assay를 통해 측정하였다(Jung et al., 2016). 돈육 3 g에 7.5% trichloroacetic acid 9 mL과 7.2% butylated hydroxytoluene 50 μL를 첨가하여 13,000 rpm으로 30초간 균질한 후(T25 basic) 3,000×g에서 10분간 원심분리하였다(1580R). 상등액을 여과지(No. 1 filter paper, Whatman)를 이용하여 여과한 후 여과액 1 mL에 20 mM thiobarbituric acid(TBA)를 용해한 0.01 N sodium hydroxide 1 mL을 첨가하였다. 혼합물을 90℃에서 30분간 반응 후 실온에서 냉각하였다. 혼합물의 흡광도는 532 nm에서 측정하였으며(Varioskan LUX), 1,1,3,3-tetraethoxypropane을 이용하여 malondialdehyde 표준 곡선을 작성하였다.
초고압 처리 돈육의 이용을 통한 인산염 대체 가능 여부를 확인하기 위해 두 그룹의 식육 균질물을 제조하였다. 대조구(control)로서 초고압 처리하지 않은 돈육을 이용 인산염을 0.3% 첨가하여 식육 균질물을 제조하였으며, 실험구(HPP)는 인산염을 첨가하지 않고 200 MPa 초고압 처리된 돈육을 이용 식육 균질물을 제조하였다. 식육 균질물의 제조는 돈육, 돈지방, 얼음, 부재료 및 첨가물을 사일런트 커터를 이용하여 분쇄 및 혼합하여 유화형 식육 균질물을 제조하였다. 식육 균질물 제조에 이용된 부재료 및 첨가물의 혼합 비율은 Table 1에 나타내었다. 유화형 소시지 모델로서 돈육 겔 제조를 위해 식육균질물을 스테인리스 용기에 45 g으로 충진한 뒤 진공 포장하였다(DWC-160). 포장한 시료는 80℃의 항온 수조에서 심부온도가 75℃가 되도록 30분간 가열 후 수돗물을 이용하여 냉각하였다. 냉각된 돈육 겔은 2℃ 냉장고에서 20일간 저장하였으며, 저장 중 돈육 겔의 감량은 진공포장지 및 표면 삼출물(소시지에서 용출된 수분 및 지방)을 paper towel을 이용하여 제거 후 측정하였다.
결과 및 고찰
Actomyosin은 사후 근육 내 ATP가 고갈됨에 따라 actin과 myosin이 가교결합한 형태로, 본 연구에서 200 MPa의 초고압 처리 결과 돈육의 actomyosin 함량이 대조구와 비교하여 유의적으로 감소함이 확인되었다(Fig. 1, p<0.05). 기존 연구에 따르면 식육에 100–300 MPa의 초고압 처리 시 actomyosin이 해리됨이 보고되었다(Simonin et al., 2012; Sun and Holley, 2010). 이는 초고압 처리로 인해 G-actin의 복합체인 F-actin이 G-actin으로의 해중합됨에 따라 근원섬유내 얇은 초원섬유(thin filament)의 구조가 일부 붕괴됨에 따른 결과로 생각된다(Chen et al., 2018; Ikeuchi et al., 1992). 또한 초고압 처리에 따른 actomyosin의 해리는 근원섬유 단백질의 용해도를 증가시키는 것으로 보고되고 있다(Chen et al., 2018). 하지만 본 연구의 결과, 근원섬유 단백질의 용해도가 증가하는 경향을 보였으나(p=0.09), 유의적인 차이는 나타나지 않았다.
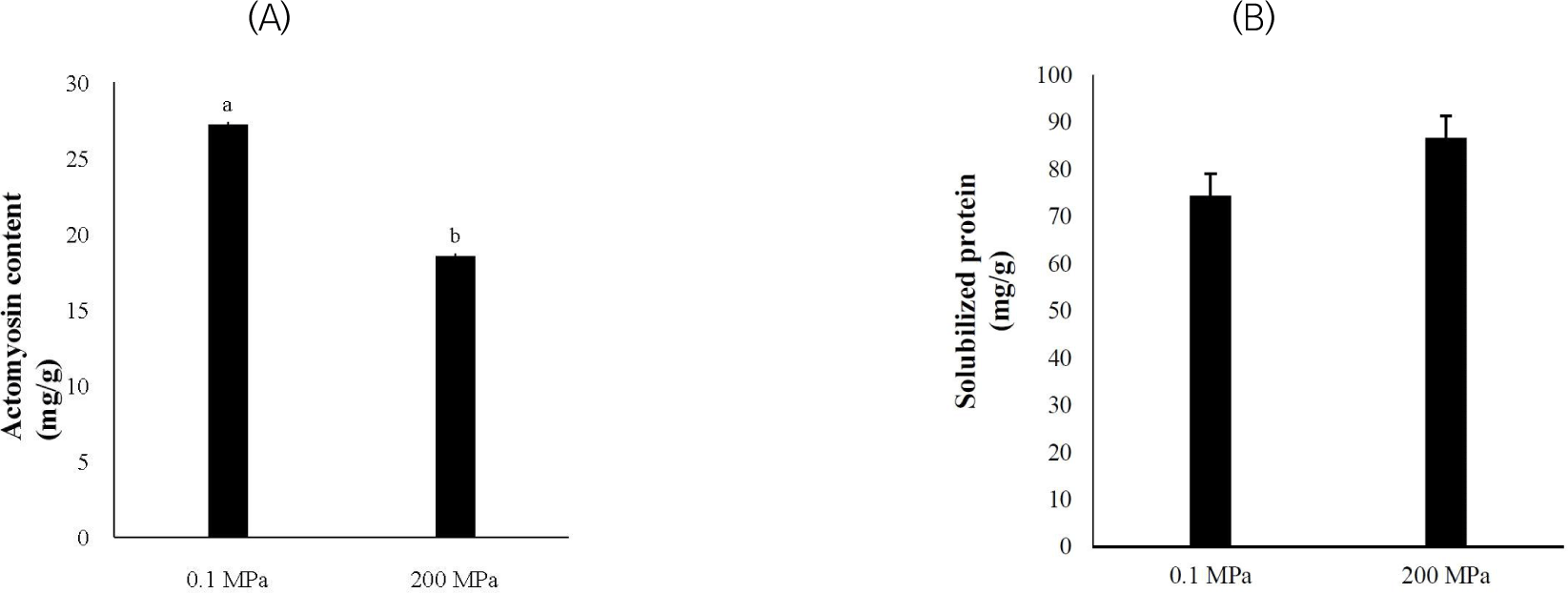
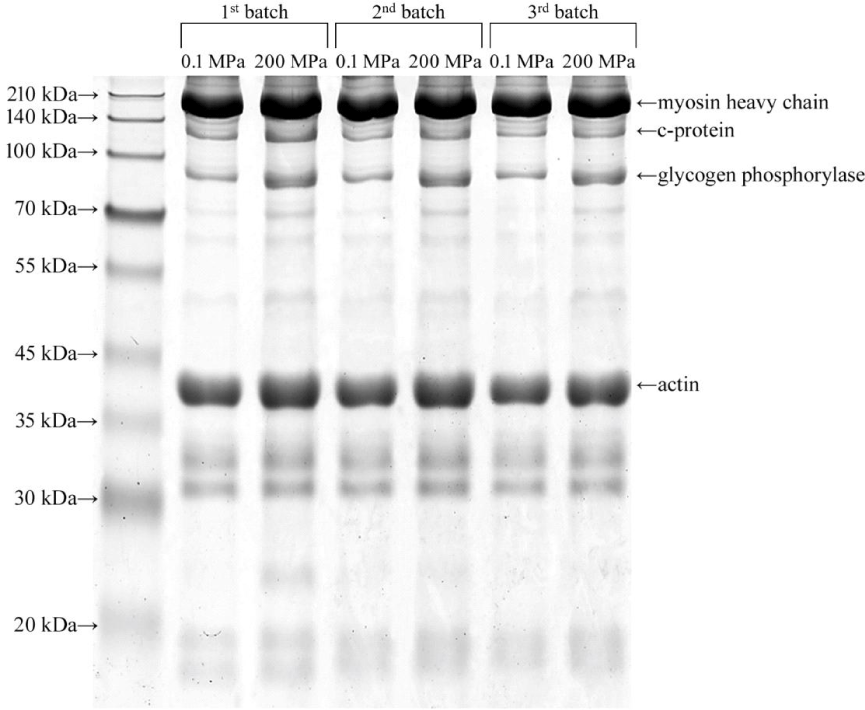
하지만 돈육 근원섬유 단백질 추출물의 SDS-PAGE 결과, 대조구와 비교하여 200 MPa 초고압 처리 돈육에서 3가지 단백질의(myosin heavy chain, glycogen phosphorylase, actin) 밴드 강도가 유의적으로 높은 것으로 확인되었다(Table 2 and Fig. 2, p<0.05). Glycogen phosphorylase는 근육 내 존재하는 glycogen을 해당과정으로 이끄는 효소이다(Wang et al., 2017). 200 MPa에서 glycogen phosphorylase의 밴드 강도의 증가는 근장 단백질에 존재하던 glycogen phosphorylase가 변성되어 근원섬유 단백질 사이에 침착됨에 따른 결과로 생각된다(Morton et al., 2018). Myosin heavy chain과 actin의 밴드 강도 증가는 actomyosin이 해리됨에 따라 myosin과 actin의 용해도가 증가함에 따른 결과로 생각된다. Myosin은 분쇄 육제품 제조 시 겔 구조를 형성하는 단백질로 용해된 단일 myosin 단백질은 구조적으로 안정되며, 효과적으로 지질 및 물을 포집할 수 있는 겔을 형성하는 것으로 알려져 있다(Jia et al., 2023). 따라서 초고압 처리를 통해 돈육의 가공적성이 개선되었다고 할 수 있다.
초고압 처리는 단백질의 이온 결합, 수소 결합, 소수성 결합과 같은 비공유 결합에 영향을 미칠 수 있으며, 근원섬유 단백질의 구조 변화는 식육 자체의 기능적 특성은 물론 가공 후 제품의 관능적 품질에도 영향을 미칠 수 있다(Zhang et al., 2017). 본 연구에서는 초고압 처리에 따른 단백질 구조 변화 확인을 위해 식육 가공품 제작 시 겔 형성능에 영향을 미치는 대표적 근원섬유 단백질인 myosin의 구조를 관찰하였다.
초고압 처리된 돈육 myosin의 2차 구조 변화를 측정한 결과, α-helix 함량은 증가하고 β-sheet와 random coil 함량은 대조구와 비교하여 감소함이 나타났다(Table 3, p<0.05). 이는 초고압 처리 시 수소 결합 붕괴로 인해 단백질의 해리와 중합이 함께 발생하였음을 의미한다(Liu et al., 2021). 초기 수소 결합 붕괴로 인해 β-sheet 구조가 구조적 무질서함을 나타내는 random coil로 개화되고(Alvarez et al., 2008) 이후 random coil이 안정된 구조를 나타내는 α-helix로 전이됨에 따른 결과로 생각된다(He et al., 2018). 이는 200 MPa의 압력에서 초고압 처리 후 근원섬유 단백질의 α-helix 함량 증가와 β-sheet 함량 감소를 보고한 Yang 등(2021b)의 연구와 동일한 결과이며, 초고압 처리가 myosin의 2차 구조의 변화를 유도할 수 있음을 의미한다. 기존 연구에 따르면 myosin의 2차 구조는 myosin 겔의 특성에 영향을 미치는 것으로 알려져 있다. Liu 등(2010)에 따르면 myosin의 α-helix 함량은 가열 처리를 통해 생성된 myosin겔의 탄성계수 및 보수력과 각각 부 및 정의 상관관계가 있음을 보고하였다.
| Treatment1) | α-Helix | β-Sheet | β-Turn | Random coil |
|---|---|---|---|---|
| 0.1 MPa | 16.15b | 25.94a | 17.57 | 40.34a |
| 200 MPa | 18.26a | 24.63b | 17.59 | 39.52b |
| SEM2) | 0.229 | 0.143 | 0.017 | 0.088 |
Myosin의 표면 소수성 측정 결과 200 MPa 초고압 처리된 돈육 myosin에서 대조구(0.1 MPa)와 비교하여 표면 소수성이 감소함이 확인되었다(Table 4, p<0.05). 초고압 처리 시 단백질의 개화가 발생하여 표면 소수성이 증가하는 것으로 알려져 있다(Yang et al., 2021a). 하지만 개화된 단백질이 증가함에 따라 개화된 단백질간 상호작용을 통해 응집이 발생하며, 이때 표면에 존재하던 소수성 잔기가 오히려 내부로 묻히는 결과가 나타날 수 있다(Huang et al., 2014). 따라서 본 연구에서 200 MPa 압력의 초고압 처리로 인해 돈육 myosin의 일부 응집에 발생한 것으로 생각된다.
| Treatment1) | Bound BPB (μg) | Sulfhydryl group (nmol/mg) |
|---|---|---|
| 0.1 MPa | 20.60a | 19.18 |
| 200 MPa | 14.12b | 20.44 |
| SEM2) | 1.758 | 1.013 |
외부 요인에 따른 단백질의 개화 발생시 3차 구조를 형성하는 disulfide 결합이 해리됨에 따라 free sulfhydryl 그룹의 함량이 증가하며, 개화된 단백질 간 disulfide 결합을 통한 응집 발생시 free sulfhydryl 함량이 감소한다(Cheng et al., 2022). 본 연구에서는 myosin의 총 free sulfhydryl 그룹 함량은 0.1 MPa와 200 MPa 사이 유의적인 차이가 나타나지 않았다(Table 4, p>0.05). 본 연구에서 myosin의 표면 소수성 변화 결과를 고려하였을 때, 초고압 처리로 인해 myosin 단백질의 개화가 발생하였지만, 단백질간 일부 응집이 발생함에 따라 총 free sulfhydryl 함량에 차이가 없는 것으로 생각된다.
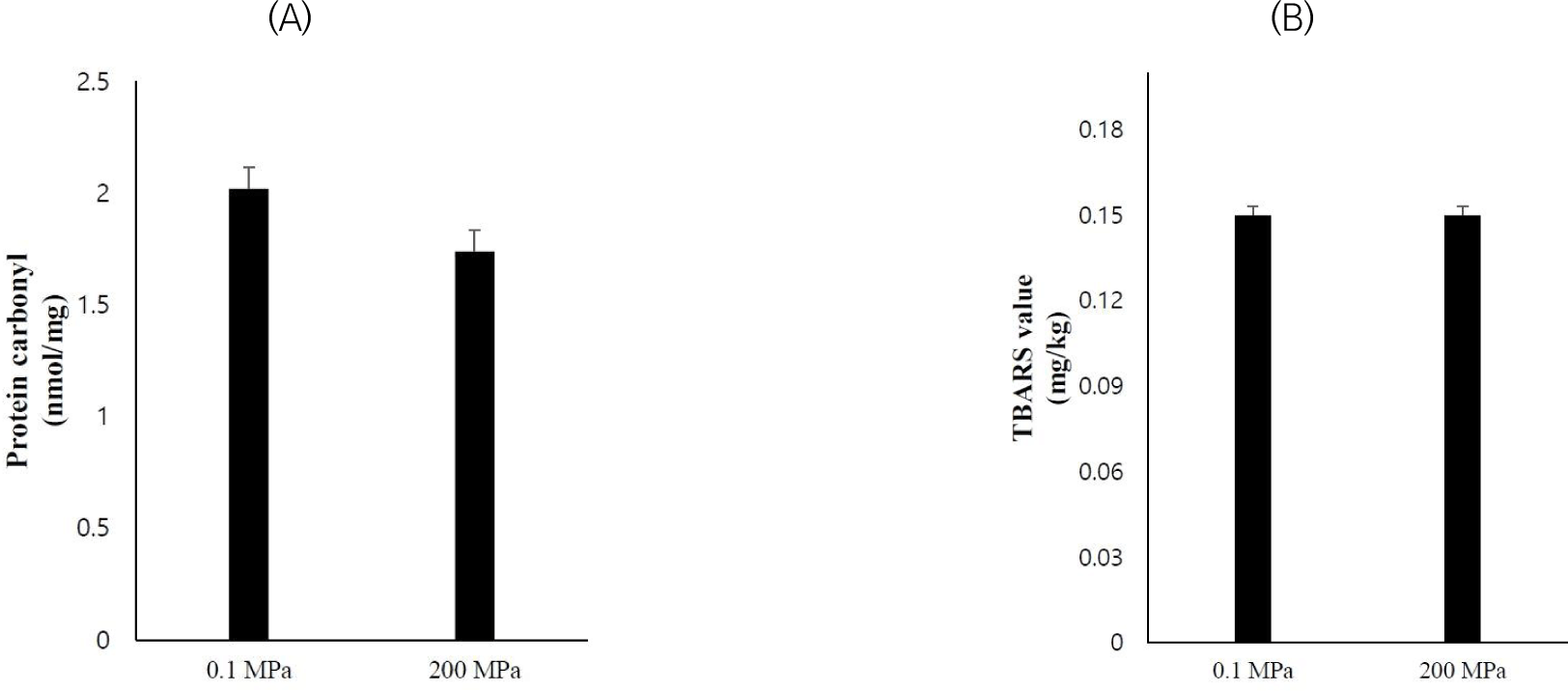
단백질의 산화 발생 시 carbonylation의 발생에 의해 형성되는 carbonyl기는 주변 아미노산과 상호작용 및 가교결합하여 단백질 분자 간 정전기적 반발력을 감소한다(Estévez, 2011). 따라서 단백질 산화의 발생은 단백질의 기능적 품질 저하할 뿐 아니라 최종 제품의 수율과 조직감의 저하를 유도할 수 있다(Lee et al., 2021). 지질 산화 발생 시 생성되는 aldehyde, ketone, alcohol, hydrocarbon 등은 발암 잠재성이 보고되었을 뿐 아니라 단백질의 산화를 촉진하고 이취를 발생하여 풍미를 저하할 수 있다(Jung et al., 2016). 따라서 단백질과 지질 산화의 발생은 식육의 기능적, 영양적 품질을 모두에 부정적 영향을 미치는 요인이다. 본 연구에서는 초고압 처리에 따른 단백질 산화와 지방 산화 발생 정도를 파악하기 위해 단백질 carbonyl기 함량과 지질 산화 2차 생성물인 malondialdehyde 함량을 나타내는 TBARS value를 확인하였다(Fig. 3). 단백질 carbonyl기와 TBARS value 모두 0.1 MPa와 200 MPa 사이 유의적 차이가 나타나지 않았다(p>0.05). 식육의 초고압 처리는 라디칼 형성 또는 근섬유 내 산화 효소 방출 등의 기작으로 단백질과 지방의 산화를 촉진할 수 있는 것으로 알려져 있다(Guyon et al., 2016). 하지만 초고압의 산화 촉진은 처리 압력과 시간에 따라 다르게 나타날 수 있으며, Medina-Meza 등(2014)의 연구에서 300 MPa 이하의 초고압 처리는 산화에 미미한 영향을 미침을 보고하였다. 따라서 본 연구에서 이용한 초고압 처리 조건(200 MPa에서 3분)은 돈육의 단백질 및 지방 산화를 촉진하지 않은 것으로 생각된다.
분쇄형 육가공품 제조 시 가열 전 식육 균질물의 pH는 가열 후 제품의 가열 감량 및 조직감을 결정하는 주요 요인이며, 원료육의 특성과 첨가물에 의해 변화한다. 식육 균질물 pH 측정 결과, 인산염을 첨가한 대조구(control)의 pH는 6.42로 인산염을 첨가하지 않고 초고압 처리된 돈육을 이용한 실험구(HPP)의 pH 6.23보다 유의적으로 높은 것이 확인되었다(Table 5, p<0.05). 이는 본 연구에서 이용한 sodium pyrophosphate가 강한 염기성 물질임에 따라 인산염 첨가시 식육 균질물의 pH가 올라가기 때문이다(Long et al., 2011). 반면 HPP의 경우, 인산염을 첨가하지 않았기 때문에 HPP 균질물의 pH가 유의적으로 대조구와 비교하여 낮은 결과가 나타났다.
| Treatment1) | pH | Purge loss (%) | ||
|---|---|---|---|---|
| 1 day | 10 day | 20 day | ||
| Control | 6.42a | 3.49b | 2.61 | 2.24 |
| HPP | 6.23b | 7.04a | 2.99 | 2.64 |
| SEM2) | 0.007 | 0.427 | 0.504 | 0.458 |
가열 중 단백질 간 상호작용을 통해 겔을 형성하고 수분과 지방을 포집할 수 있는 능력은 육가공품 제작 시 식육 단백질의 중요한 특성 중 하나이다. 가열 중 발생하는 감량은 제품의 수율과 직결되며, 조직감과 같은 제품의 최종 품질에 영향을 미친다(Jo et al., 2022). 돈육 겔의 가열 직 후(1 day) 감량율은 HPP에서 7.04%로, 대조구의 3.49%보다 유의적으로 높았다(Table 5, p<0.05). 분쇄형 육제품 제조시 인산염 첨가는 식육균질물의 pH를 증가시켜 근원섬유 단백질 간 정전기적 반발력을 유도하여 보수력을 증가시키고, actomyosin 해리를 통한 염용성 단백질 용해도를 증가시켜 용해된 단백질들이 수분을 포집하며 효과적으로 겔을 형성한다(Park et al., 2017). 본 연구에서 HPP 식육 균질물의 pH가 대조구보다 낮음에 따라 보수력이 낮아 감량이 크게 발생한 것으로 사료된다. 기존 연구들에 따르면 본 연구와 유사한 배합비로 인산염 무첨가 소시지 제조시 가열 감량이 21% 정도 발생함을 보고하였다(Choe et al., 2018; Jeong et al., 2023). 하지만 본 연구에서 HPP 겔의 가열 후 감량은 7.04%로 기존 연구의 인산염 무첨가 소시지의 가열 감량과 비교하여 낮은 것을 알 수 있다. 게다가 저장 10 및 20일차의 감량율을 측정한 결과 대조구와 HPP 사이 감량율 차이에 유의적인 차이가 없는 것이 확인되었다. 기존 연구에 따르면 인산염 무첨가 대조구의 경우, 인산염 첨가 돈육 겔과 비교하여 저장기간 전 기간에서 가열 감량이 높게 나타난 반면, 온도체를 이용하여 인산염 무첨가 돈육 겔을 제조한 결과 보수력이 개선됨에 따라 제조 직후 가열감량은 높았으나, 저장 중 삼출물이 흡수되어 인산염 첨가구와 감량에 차이가 없음을 보고하였다(Jeong at el., 2023). 이는 가열에 의해 수축되었던 근섬유들의 팽창과 변성된 단백질의 수화로 삼출물이 내부로 재 흡수됨에 따른 결과로 보고되고 있다(Cropotova et al., 2018). 또한, 돈육 myosin의 2차 구조 분석 결과, 200 MPa를 처리한 돈육이 대조구와 비교하여 α-helix의 비율이 증가하였는데, α-helix는 식육의 보수력간의 정의 상관관계가 있음이 보고되고 있다(Liu et al., 2010). 따라서 초고압 처리를 통해 돈육의 가공 적성이 개선됨에 따라 인산염을 첨가하지 않았음에도 초고압 처리 돈육 이용시 돈육 겔의 감량이 감소한 것으로 사료된다.
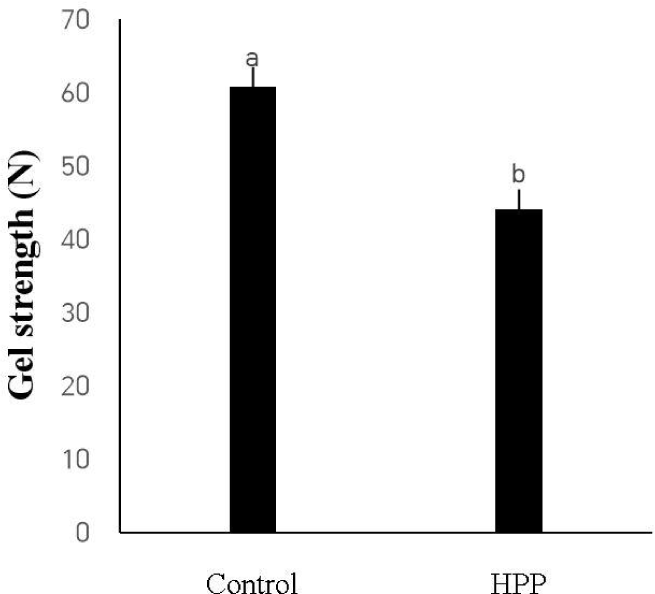
돈육 겔의 강도 분석 결과, HPP 소시지에서 겔 강도가 유의적으로 대조구보다 낮은 것으로 나타났다(Fig. 4, p<0.05). 기존 인산염을 대체하기 위해 진행된 연구에서, 인산염 무첨가시 actomyosin이 해리되지 않고 이로 인해 낮은 용해도가 나타나 견고한 겔을 형성하지 못하였다(Jeong et al., 2023). 그러나, 인산염 무첨가 겔을 제조할 시 이용된 원료육에서 초고압 처리로 인한 actomyosin의 해리가 발생되었으나(Fig. 1), 여전히 낮은 겔 강도가 관찰되었다. 인산염 첨가 시 지방구를 감싸고 있는 계면 단백질과 용해되지 않은 근섬유 단백질 간의 이황화 결합 및 인산염 첨가로 인한 근원섬유 단백질의 아미노기와 음이온성 인산기의 결합으로 인하여 견고한 겔 구조가 형성됨이 보고되고 있다(Chen et al., 2019). 이를 통해, 초고압 처리로 인하여 actomyosin의 해리가 나타났으나 인산염의 무첨가에 의한 인산결합의 부재로 인해 상대적으로 견고하지 못한 겔을 형성한 것으로 사료된다.
결 론
본 연구는 초고압 처리 돈육을 이용 돈육 겔을 제조하여 인산염 무첨가 클린 라벨 소시지의 제조 가능성 여부를 확인하기 위해 수행되었다. 돈육의 200 MPa 초고압 처리를 통해 actomyosin의 해리를 포함한 가공적성이 개선됨을 확인하였다. 초고압 처리 돈육으로 인산염 무첨가 돈육 겔 제조 결과, 제조 직후 가열감량은 대조구와 비교하여 높았지만, 저장 중 감량은 대조구와 차이가 없음을 확인하였다. 하지만 초고압 처리 돈육을 이용한 돈육 겔의 강도가 인산염 첨가 돈육 겔인 대조구와 비교하여 낮은 결과가 나타났다. 따라서, 초고압 처리를 통해 돈육의 가공적성을 개선시켜 보수력이 증진된 인산염 무첨가 소시지의 제조가 가능할 것으로 생각된다. 하지만 돈육 겔 강도 증가를 위한 추가적인 연구가 필요할 것으로 사료된다.
