서 론
세계보건기구 국제 암 연구소에서 적색육 및 가공육에서 발암물질이 생성될 수 있다는 평가를 내리면서 식품에 대한 위해성과 안정성이 국내·외적으로 큰 논란이 된 적이 있다. 그럼에도 불구하고 전세계적으로 육류 소비량은 지속적으로 증가하고 있는 추세이며, 건강에 대한 관심이 높아지면서 육류 섭취가 건강에 긍정적 영향을 미칠 수 있는 방법 또한 다양하게 연구되고 있다(Kang et al., 2022). 육류 및 어류를 150℃ 이상의 고온으로 조리할 경우, 헤테로사이클릭 아민류(heterocyclic amines, HCAs), 다환방향족 탄화수소(polycyclic aromatic hydrocarbon, PAHs) 등과 같은 발암물질이 생성될 가능성이 있다(Kang et al., 2022; Kim, 2009). 특히, 1977년 조리된 어육 및 우육의 표면에서 처음 발견된 HCAs는 고온에서 조리 시 마이야르 반응에 의하여 생성되며, 조리 온도, 시간, 방법, 육의 종류 또는 성분 등이 생성에 큰 영향을 주는 것으로 알려져 있다(Dong et al., 2011; Nagao et al., 1977). HCAs는 체내에서 N-hydroxylated by cytochrome P450 1A2(CYP1A2) 효소에 의하여 DNA adduct를 생성하고(Turesky, 2007), 이는 발암 억제 단백질의 돌연변이와 유전적으로 일치하는 DNA sequence로 변형되어 암 발생의 주요 원인이 된다고 보고되었다(Alaejos et al., 2008; Snyderwine et al., 2002). 발암물질의 생성 기작을 규명하고, 이를 감소시키기 위한 다양한 선행연구가 수행되어 왔으며(Kang et al., 2022), 항산화 물질 및 황 화합물에 의한 마이야르 반응 억제와 probiotics에 의한 장내 세포 및 장벽 보호 등의 연구 결과가 보고되었다(Lee et al., 2020; Myung and Joo, 2012). 따라서 본 연구에서는 HCAs의 특성과 다양한 발생 기작 등을 연구함으로써 건강한 식육 제품의 생산을 위한 기초자료를 제공하기 위해 수행되었다.
결과 및 고찰
HCAs는 어류 및 육류, 특히 적색육을 100℃ 이상의 고온에서 조리하였을 경우, 발생 가능한 발암 또는 돌연변이 유발 물질이며(Gibis, 2016), Nagao 등(1977)에 의하여 가스 버너로 조리한 어육 및 숯으로 조리한 우육의 표면에서 Ames’ Salmonella bacterial mutation test를 통해 처음 발견되었다(Kang et al., 2022). 이후 어류 및 육류를 조리하였을 때 생성되는 HCAs와 관련된 많은 연구가 진행되어 왔으며(Table 1), 현재는 25가지 이상의 HCAs 종류가 분리되었다. HCAs의 생성을 초래하는 원인이 다양하게 밝혀진 가운데 육의 종류, 조리 시간, 온도, 방법 또는 수용성 전구 물질 등이 가장 큰 영향을 미친다고 알려져 있다(Dong et al., 2011). 1993년 국제 암 연구 기구(The International Agency for Research on Cancer, IARC)에 의하여 인체 발암성 추정 및 동물 발암성 추정 물질인 PhIP(2-amino- 1-methayl-6-phenyl-imidazo [4,5-b] pyridine), MeIQ(2-amino- 3,4-dimethyle-3H-imidazo[4,5-f]quino-line) 및 MeIQx(2-amino- 3,8-dimethylimidazo[4,5-f] quinoxaline)가 class 2B로 지정되었고, 특히 IQ(2-amino-3-methylimidazo [4,5-f] quinoline)은 동물 발암성이 입증되어 class 2A로 분류되었다(Gibis, 2016; Kang et al., 2022). 선행 연구에 따르면 육류 및 어류를 통한 HCAs의 과량 섭취는 대장, 간, 위, 유선 또는 생식기 등에 암을 유발하는 위험 요인으로 알려져 있다(Tsen et al., 2006). 따라서 육류 및 어류 내 HCAs의 생성을 줄이기 위한 다양한 연구가 진행되어 왔는데, 대표적인 방법으로 항산화물질을 함께 섭취할 때 HCAs 생성 저감의 효과를 확인할 수 있었다(Ahn and Grün, 2005; Tsen et al., 2006). Jung and Shin(2009)은 쇠고기를 고온으로 가열하기 전에 전자레인지로 예열하는 시간이 길수록 적은 양의 HCAs가 생성되는 것을 확인하였다.
| Meat type | Cooking method | Cooking temp. (°C) | Cooking time (min) | IQx | IQ | MeIQ | MeIQx | DiMeIQx | PhIP | Reference |
|---|---|---|---|---|---|---|---|---|---|---|
| Beef patty | Pan fry | 225 | 12 | - | 2.8 | 2.0 | 3.5 | 3.0 | 13.3 | Balogh et al., 2000 |
| Pan fry | 225 | 20 | - | 5.3 | 3.5 | 5.8 | 4.8 | 31.4 | Balogh et al., 2000 | |
| Pan fry | 200 | 14 | - | 1.36 | nd | 0.3 | 1.4 | 0.9 | Klassen et al., 2002 | |
| Pan fry | 220 | 14 | - | 1.7 | nd | 0.3 | nd | 0.2 | Klassen et al., 2002 | |
| Pan fry | 160 | 14 | - | 0.4 | nd | 0.3 | 1.8 | 1.1 | Klassen et al., 2002 | |
| Pan fry | 230 | 10 | - | 0.7 | - | 7.3 | 1.0 | 32.0 | Knize et al., 1994 | |
| Pan fry | 170 | 12 | - | nd | 9.3 | - | 6.32 | nd | Janoszka et al., 2009 | |
| Pan fry | 204 | 12 | - | - | - | 3.3 | 0.3 | 5.3 | Puangsombat et al., 2012 | |
| Pan fry | 200 | 20 | - | 3.2 | 2.0 | 22.7 | 1.7 | 12.1 | Ahn and Grün, 2005 | |
| Pan fry | 230 | 8 | - | nd | 6.6 | 21.6 | 1.4 | 73.38 | Dong et al., 2011 | |
| Pan fry | 190 | 10 | - | nd | - | 1.3 | 1.1 | 9.8 | Knize et al., 1994 | |
| Beef chop | Barbecue | 2001) | 6 | nd | 0.78 | 0.62 | 0.31 | 0.28 | nd | Oz et al., 2010 |
| Pan fry | 2001) | 6 | 0.61 | 0.68 | 0.35 | nd | nd | nd | Oz et al., 2010 | |
| Beef meatball | Pan fry | 1801) | 16 | - | 44.7 | - | nd | nd | 1.1 | Keşkekoğlu et al., 2014 |
| Barbecue | 1801) | 20 | - | 303.1 | - | 35.2 | nd | 1.2 | Keşkekoğlu et al., 2014 | |
| Oven | 1801) | 27 | - | 139.2 | - | 29.6 | nd | 0.6 | Keşkekoğlu et al., 2014 | |
| Pork patty | Pan fry | 204 | 6 | nd | - | - | 1.1 | 1.2 | 1.8 | Puangsombat et al., 2012 |
| Pan fry | 180 | 5 | - | - | - | 3.2 | 0.71 | 18.4 | Zhang et al., 2013 | |
| Pork chop | Pan fry | 177 | 9 | - | - | - | 0.6 | 0.3 | 0.3 | Shin, 2005 |
| Pan fry | 225 | 21 | - | - | - | 5.0 | 1.7 | 10.5 | Shin, 2005 | |
| Broil | 177 | 12 | - | - | - | 1.2 | 0.3 | nd | Shin, 2005 | |
| Broil | 225 | 19 | - | - | - | 1.6 | 0.7 | 2.7 | Shin, 2005 | |
| Boil | 100 | 8 | - | - | - | 0.4 | nd | nd | Shin, 2005 | |
| Bacon | Pan fry | 172 | 3 | 3.1 | - | - | 4.0 | 3.6 | 6.9 | Puangsombat et al., 2012 |
| Chicken meatball | Pan fry | 180 | 16 | - | 5.5 | - | 6.1 | nd | 0.8 | Keşkekoğlu et al., 2014 |
| Barbecue | - | 20 | - | 55.5 | - | nd | nd | 0.9 | Keşkekoğlu et al., 2014 | |
| Chicken breast | Pan fry | 180 | 5 | - | 0.6 | 0.2 | 1.2 | 0.5 | 6.1 | Bermudo et al.,2005 |
| Pan fry | 200 | 8 | - | nd | 15.3 | 15.0 | nd | 109.4 | Dong et al., 2011 | |
| Pan fry | 220 | 12 | - | - | - | 1.0 | 0.5 | 29.7 | Solyakov et al., 2002 | |
| Pan fry | 180 | 10 | - | 1.8 | - | 1.8 | 1.1 | 18.3 | Liao et al., 2010 | |
| Barbecue | 180 | 5 | - | nd | nd | 0.3 | 0.3 | 3.4 | Bermudo et al.,2005 | |
| Oven | 345 | 40 | - | - | - | 1.7 | 0.3 | 3.0 | Solyakov et al., 2002 | |
| Oven | 200 | 20 | - | nd | - | nd | nd | 0.04 | Liao et al., 2010 | |
| Boil | 100 | 23 | - | - | - | nd | nd | nd | Solyakov et al., 2002 |
Before cooking by various methods, the meat surfaces were preheated up to this temperature, then the meat were cooked by cooking methods and time. Modified from Kang et al. (2022).
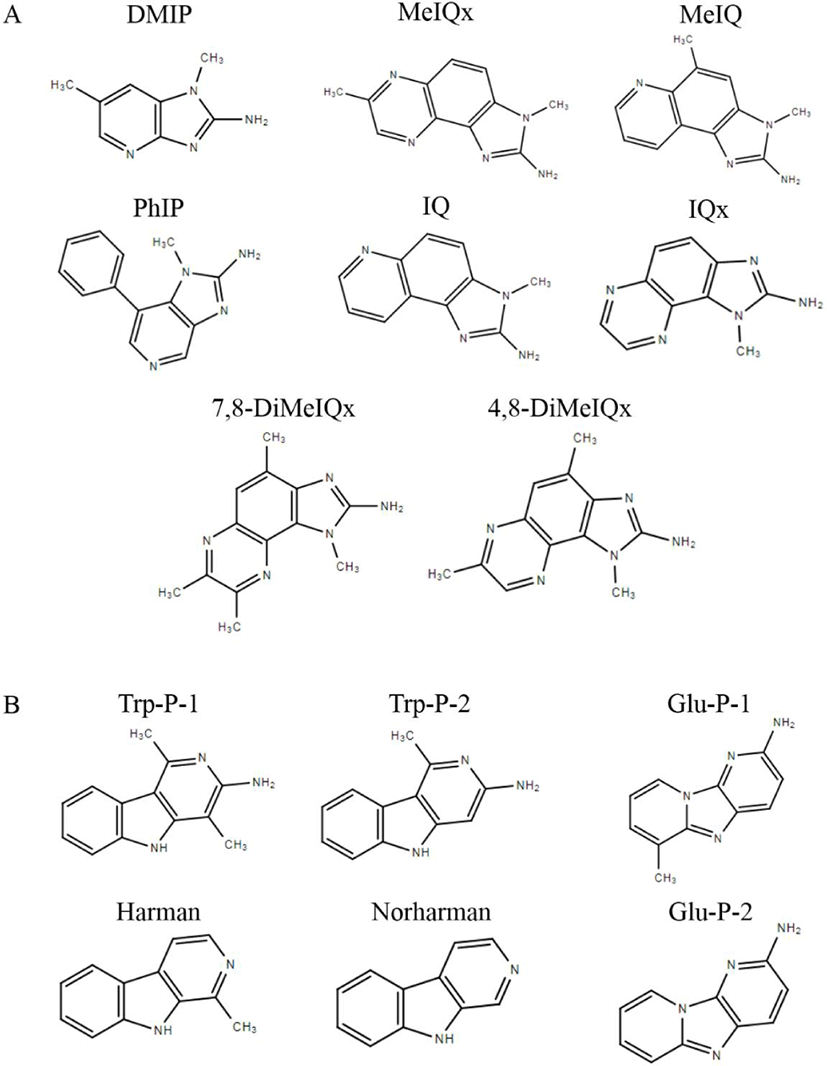
HCAs는 구조에 따라 aminoimidazoazoarenes(AIAs), aminocarbolines(ACs) 그룹으로 분류되며(Fig. 1, Kang et al., 2022), Table 2는 AIAs 그룹, Table 3은 ACs 그룹의 화학명, 약자, 특성 및 분자량을 나타내었다(Kang et al., 2022). AIAs는 imidazoquinoline(IQ)-type compounds 또는 thermic HCAs라고도 불리며, quinolone, quinoxaline, pyridine이 연결된 imidazol기를 갖고, 150℃–300℃에서 음식을 조리하는 동안 아미노산(amino acid), 크레아틴(creatine) 또는 크레아티닌(creatinine)의 반응으로 생성된다(Gibis, 2016; Kang et al., 2022). AIAs는 300℃ 이하에서 생성되기 때문에 가정에서 조리하는 조건에서도 충분히 생성 가능하다(Kang et al., 2022; MFDS, 2017). AIAs에 속하는 대표적인 HCAs는 PhIP, MeIQx (2-amino-3,8-dimethylimidazo[4,5-f] quinoxaline), MeIQ, IQx(2- amino-3-methyle- 3H-imidazo[4,5-f]quinoxaline), IQ, 4,8-DiMeIQx (2-amino-3,4,8- trimethyle-3H-imidazo[4,5-f]quinoxaline), 7,8-DiMeIQx(2-amino- 3,7,8-trimethyle-3H-imidazo[4,5-f]quino-xa-line), Tri-MeIQx(2-amino- 3,4,7,8-tetramethyle-3H-imidazo [4,5- f]quinoxaline) 등이 있으며, 이는 극성 성질을 갖는다(Kang et al., 2022). Aminocarbolines는 non-IQ-type compounds 또는 pyrolytic HCAs라고 불리며, 공통적 구조로서 아미노 그룹이 pyridine 고리를 갖고, 300℃ 이상 고온에서 조리하는 경우 아미노산 및 단백질의 pyrolytic 반응에 의하여 형성된다(Kang et al., 2022; Tsen et al., 2006). Aminocarbolines에 속하는 대표적인 HCAs는 AαC(2-amino- 9H-pyrido [2,3-b]indole), MeAαC(2- amino-3-methyl-9H-pyrido [2,3-b]indole), Harman(1-methyl-9H-pyrido[4,3-b]indole), Nor-harman (9H-pyrido [4,3-b]indole), Trp-P-2(3-amino-1-methyl-5H-pyrido [4,3-b]indole), Glu-P-2(2-amino- dipyrido[1,2-a:3’ 2’-d]imidazole) 등이 존재하며, 비극성 성질을 갖는다(Gibis, 2016; Kang et al., 2022; Tsen et al., 2006).
HCAs는 특히 동물성 식품을 조리하였을 때 주로 발행하는 화합물로서, 근육 조직의 구성요소인 당(sugar), 아미노산(amino acid) 또는 크레아틴(creatine), 크레아티닌(creatinine) 등이 그 전구체이다(Salmon et al., 1997; Tsen et al., 2006). 식품의 조리 및 가공에 의하여 IQs 및 imidazoquinoxalines이 형성되고(Kato et al., 1996), 마이야르 반응(Maillard reaction)에 의한 스트레커 분해(Strecker degradation)를 통하여 생성된다(Kang et al., 2022; Tsen et al., 2006).
마이야르 반응(Maillard reaction)이란 비효소적 갈변 반응으로, aldehyde류, ketone류의 환원당류와 펩타이드, 아미노산, 단백질 등의 자유 아미노산이 서로 반응하여 색소 형성 및 풍미가 발현하는 것을 말한다(Danehy, 1986; Kang et al., 2022).
마이야르 반응의 최종 산물로서 향미 물질이 생성되는 과정은 Fig. 2에 나타내었으며, 세 단계로 진행된다(Kang et al., 2022; van Boekel, 2006). 초기 응축 단계는 아미노 그룹 및 환원당의 반응으로 시작하여 aldose가 질소 배당체인 N-glycosylamine을 생성한다(van Boekel, 2006). 이후 질소 배당체가 단당류유도체로 변환되는 아마도리 전위(Amadori rearrangement)에 의하여 케토아민(ketoamine)이 형성되는데, 아마도리 전위 속도에 따라 케토아민 형성 속도 및 전체 마이야르 반응 속도가 결정된다(Kang et al., 2022; van Boekel, 2006). 다음 산화물 분해 단계로 케토아민(ketoamine)이 데옥시오존(deoxyosones), 다이데옥시오존(dideoxyosones), 하이드록시메틸푸르푸랄(hydroxymethylfurfural, HMF) 및 리덕톤(reductone) 순으로 산화된다(O’Brien et al., 1989). 최종 스트레커 분해 단계(Strecker reaction)는 리덕톤이 아미노산과 반응하며, 아미노산의 탈탄산 및 탈아미노 반응을 거쳐 알데하이드(aldehyde), 탄산가스 등이 생성된다(Kang et al., 2022; O’Brien et al., 1989). 일부 리덕톤은 알돌축합(aldol condensation) 반응을 거치면서 알코올 성분 및 카보닐기의 축합 반응을 유도한다(Kang et al., 2022). 이러한 과정이 반복되면서 멜라노이드 성분이 발생하고, 휘발성 향미 물질이 생성되어 풍미가 발현된다(Kang et al., 2022; O’Brien et al., 1989). 이러한 향미 물질이 전구체가 되어 활성산소를 형성함으로써 oxazoles, imidazoles, pyridines, thiazoles, pyrazines 또는 pyrroles와 같은 발암성 방향족 유기 화합물이 생성된다(Kang et al., 2022; van Boekel, 2006). 특히, pyridines은 imidazole기와 연결되면 IQ-type compounds(IQx, MeIQx 등)로, 아미노 그룹과 연결되면 non-IQ-type compounds(Harman, Trp-P-2 등)로 합성된다(van Boekel, 2006).
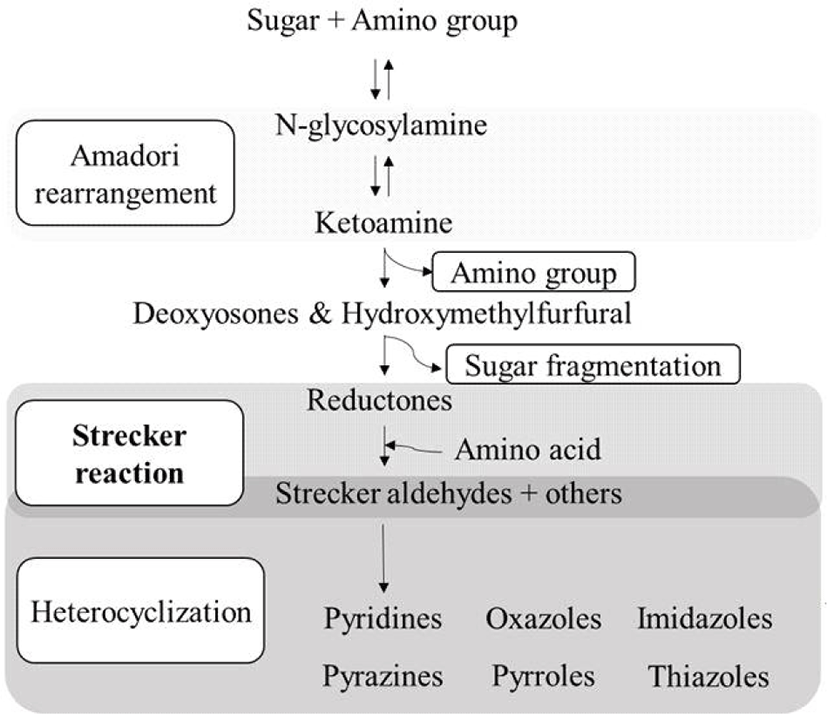
스트레커 분해는 1862년 A. Strecker에 의하여 처음 발견되었고, 알라닌과 류신이 알록산(alloxan)에 반응하면서 아세트알데하이드(acetaldehyde)와 이소발레르알데하이드(isovaleraldehyde)가 형성되는 것을 의미한다(Kang et al., 2022; Strecker, 1862). 고기를 가열했을 때 발생하는 풍미(flavor)를 위하여 수용성 전구체의 마이야르 반응 및 지질의 열분해는 매우 중요하다(Kang et al., 2022; Mottram, 1998). 가열 시 비휘발성 물질과 지방 조직 사이의 복잡한 열 유도 반응에 의하여 많은 반응물이 발생하며, 가열하는 동안 생성된 휘발성 화합물은 고기 특유의 풍미에 기여한다(Kang et al., 2022; Mottram, 1998). 비휘발성 물질은 정미 성분, 풍미 강화, 또는 휘발성 물질의 전구체로 구성되며, 휘발성 물질은 아미노산, 글리코겐, 티아민, 당 인산염(sugar phosphates), 또는 유기산과 같은 수용성 전구체로부터 가열 시 생성된다(Bailey, 1994; Kang et al., 2022).
일반적으로 스트레커 분해는 마이야르 반응 경로에서 유도되며, α-디카보닐 화합물(α-dicarbonyl compounds)과 함께 나타나는 자유 α-아미노산의 반응이다(Rizzi, 2008). 탄수화물 탈수 물질(1- 또는 3-deoxyosones)이나 그 조각 물질(glyoxal, diacetyl, 또는 pyruvaldehyde)은 α-디카보닐 반응제를 제공한다(Bailey, 1994). 반응하는 동안 α-아미노산은 탈카르복실화 과정을 거치면서 스트레커 알데하이드(Strecker aldehyde)로 변형됨에 따라 분해 과정이 이루어진다(Rizzi, 2008). 스트레커 분해의 중간산물로서 α-아미노카보닐(α-aminocarbonyl), 아실로인(acyloins), 그리고 O, N-헤테로사이클릭 화합물(O, N-heterocyclic compounds)이 생성된다고 알려져 있다(Rizzi, 2008).
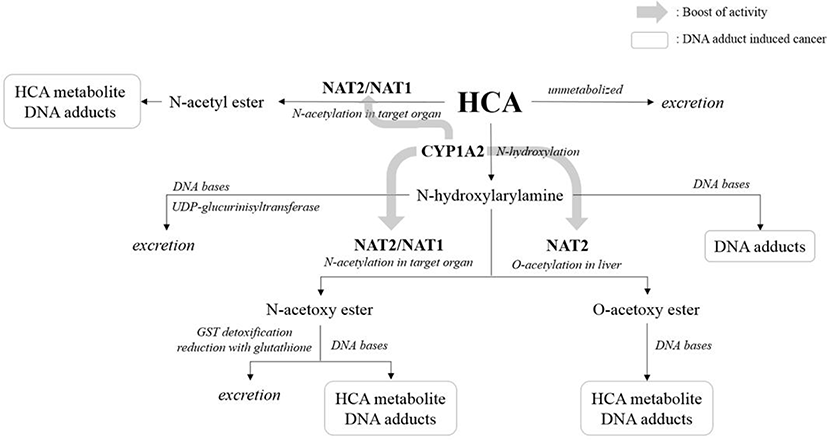
체외 조건에서 HCAs의 독성은 다양한 외적 및 내적 대사 시스템, 각각 DNA adduct의 수용 용량 또는 돌연변이 유발에 대한 유전좌위(gene locus)의 종료 등에 의하여 다른 효력을 보인다(Kang et al., 2022; Turesky, 2007). 일반적으로 HCAs는 간에서 가장 활발히 대사가 이루어지며, HCAs의 대사 과정은 Fig. 3에 나타내었다(Alaejos et al., 2008; Kang et al., 2022). 대사 과정의 시작은 HCAs의 아미노 그룹(exocyclic amino group)이 CYP1A2에 의해 N-hydroxylation 되며, 전자 친화성 발암 인자로 활성된다(Kang et al., 2022; Turesky, 2007). CYP1A2는 주로 스테로이드, 담즙산 등의 신진대사를 촉진하지만 일부는 활성 발암물질로 작용하며(Kang et al., 2022; Liong, 2008), N-acetyltransferase(NAT) 효소 활성을 촉진시키는 것으로 알려져 있다(Alaejos et al., 2008; Kang et al., 2022; Snyderwine et al., 2002). NAT2는 aromatic amines의 N- acetylation 및 N-hydroxylated derivatives의 O-acetylation 모두 관여하며, N-acetylation은 해독 작용과 관련되어 있고, O- acetylation은 활성화 작용과 관련되어 있다(Alaejos et al., 2008; Kang et al., 2022; Snyderwine et al., 2002). O-acetylation에 의하여 활성화된 에스테르(ester)는 DNA에 결합하면서 DNA adduct를 형성하거나 다른 단백질 및 세포 성분과 반응한다(Alaejos et al., 2008). 반응물은 자연적으로 5-OH-PhIP 및 다른 대사산물로 분해되고, DNA adduct는 돌연변이와 암 유발 및 유전 독성에 있어 주요 역할을 한다고 알려져 있다(Alaejos et al., 2008; Kang et al., 2022; Snyderwine et al., 2002). 일부 대사산물은 glutathione S-transferase(GST) 및 uridine 5’-diphospho- glucurinisyltrasferase(UDP-glucurinisyltrasferase)를 통하여 담즙이나 소변으로 배출되기도 한다(Alaejos et al., 2008; Kang et al., 2022).
현대인의 암 발생은 스트레스 및 흡연 등 환경적 요소뿐만 아니라, 식생활에서 많은 비중을 차지하고 있다. 대부분 식품에 의하여 직접적으로 암이 발생하지 않지만, 식품에 함유되어 있고 가공 중 발생하는 발암물질이 인체에 영향을 미친다(Kim et al., 2001). 대표적으로 곰팡이 독소(mycotoxin), N-니트로소 화합물(N-nitroso compounds), 헤테로사이클릭 아민류(HCAs), 식물 내 존재하는 사프롤(safrole) 및 카테콜(catechol), 발효 식품에 존재하는 에틸 카바메이트(ethyl carbamate)가 암을 유발한다고 알려져 있다(Kang et al., 2022; Kim et al., 2001). 그중 HCAs는 대장 및 간 등 소화기 암을 유발하는 물질로서, 처음 발견은 담배연기 및 타르에 대한 유전 독성 검사 결과가 생선을 연기에 그을렸을 때 발생되는 입자의 유전 독성 검사 결과와 비슷하다는 것을 확인한 것에서 시작되었다(Kang et al., 2022; Nagao et al., 1977). 이후에 끓인 정어리 및 구운 쇠고기에서도 열분해 산물인 HCAs를 분리하였고(Kang et al., 2022; Kim et al., 2001), 모든 HCAs는 Salmonella typhimurium에 대하여 돌연변이 유발을 확인하였을 뿐만 아니라, 실험동물의 대장, 유선, 전립선에서 암을 유발한 것을 보아 HCAs의 표적이 될 수 있음을 증명하였다(Sugimura et al., 2004). Kim(2014)의 연구에 따르면 MeIQx에 의하여 생성된 DNA adduct는 간세포 암의 발생 원인이 되는 효소 변이세포(enzyme altered cell) 발현을 유도하며, PhIP에 의한 DNA adduct는 결장의 비정상적 낭종 발생을 유도하는 것으로 보고되었다. 식품 내에서 발생 가능한 HCAs의 양은 매우 미량이지만, 지속적으로 섭취할 경우 인체에 유해할 가능성이 있기 때문에 생성 억제 연구가 활발히 진행되고 있다.
IQ, MeIQ 및 MeIQx는 유전적으로 변형된 S. typhimurium의 여러 종에 적용된 Ames assay에서 잠재적인 박테리아 돌연변이를 보였다(Turesky, 2002). 돌연변이 물질의 효력은 O-acetyltransferase(OAT) 효소에 의하여 발현되는데, OAT는 P450 효소에 의해 고반응성 N-acetoxy-HCA를 생성하고, 세포 DNA에 쉽게 결합한다(Kang et al., 2022; Turesky, 2002). 따라서 IQ와 MeIQx같이 OAT에 의하여 활성화된 HCAs는 OAT 부재 시 S. typhimurium TA98/1,8DNP6에 대한 돌연변이 유발 효력이 감소된다(Kang et al., 2022; McCoy et al., 1983; Turesky, 2002). 반대로 OAT가 풍부한 S. typhimuriumtester strain YG1024는 활성된 HCAs의 독성 효과에 더 민감하다(Kang et al., 2022; Turesky, 2002; Watanabe et al., 1990). 그러나, 박테리아의 돌연변이 유발 효력은 포유류와 유사하지 않다(Kang et al., 2022; Turesky, 2002). 포유류에서 DNA adduct는 DNA 전사 및 복제를 방해하여 단일 또는 다중 돌연변이를 유발한다고 알려져 있고, 돌연변이를 유발하기 위해서는 DNA sequence, 전이 합성 시 DNA 중합체 또는 DNA adduct 구조의 영향을 받는다(Hwa Yun et al., 2020; Kang et al., 2022). 구아닌(G) 및 티민(T)의 틀 이동 돌연변이(frameshift mutation)는 DNA sequence에 따라 발생하는 작용으로, AT, AT to GC, AT to TA 돌연변이를 유도한다(Hwa Yun et al., 2020; Kang et al., 2022; Turesky, 2002). 사람 림프구 세포에서 PhIP에 의한 돌연변이는 주로 GC to TA 변환을 통해 발생하며(Kang et al., 2022; Morgenthaler and Holzhäuser, 1995; Turesky, 2002), 햄스터 난소 세포에서 PhIP에 의한 돌연변이는 CG to AT 및 GC to TA 변환을 통해 발생한다고 보고되었다(Carothers et al., 1994; Kang et al., 2022; Turesky, 2002). G에서 T로 변환되면 인간의 p53 종양 돌연변이와 유전적으로 일치하며(Hollstein et al., 1994), p53 단백질은 암 조절에 관여하는 종양 억제 단백질로서 p53 돌연변이는 p53 활성을 방해하여 종양 발생을 유도한다(Han et al., 2018; Kang et al., 2022).
