서 론
세포 배양육은 동물에서 채취한 근육줄기세포를 증식하여 생산하는 대체식품으로 최첨단 생명과학 연구에서 핵심적인 기술 중 하나로 자리 매김하고 있다(Post et al., 2020). 살아있는 가축의 동물 조직 샘플을 채취하여 생물 반응기에서 지속 가능한 단백질을 생산하는 세포 배양육은 세포 농업의 생산물이다(Chriki and Hocquette, 2020). 전통적인 축산물의 요구량 급증으로 인해 발생할 수 있는 식량안보, 환경문제 및 윤리문제 등의 다양한 문제들을 세포 배양육은 상호보완적으로 해결할 수 있을 것으로 기대하고 있다(Lee et al., 2023). 이러한 측면에서 세포 배양육의 활용은 증가할 것으로 기대가 되고 있으며, 효율적이고 안정적인 세포 배양육 생산 프로토콜 및 중요한 관리 요소의 설정이 중요한 과제로 부각될 것이다. 세포 배양육 생산은 매우 복잡한 과정으로, 최적의 조건과 효율적인 프로토콜이 필수적이다. 제대로 설정된 프로토콜은 세포 배양육 생산의 안정성과 품질을 향상시키며, 연구 및 산업적 응용 분야에서의 세포 배양육의 신뢰성을 보장할 것이다(Choi, 2019).
세포주의 품질과 안정성은 생산의 핵심적인 영역 중 하나로, 이는 세포 배양육에서의 성공적인 생산에 있어서 기본 요건 중 하나이다(Ramani et al., 2021). 또한, 배양 배지의 선택과 구성은 세포의 적절한 성장 및 기능 유지를 보장하는 데 핵심적인 역할을 한다. 다양한 세포주와 배지의 특성을 고려하여 최적의 프로토콜을 설정하는 것이 필수적이다(Choi et al., 2021). 온도, 습도, pH, 및 기타 환경 조건의 최적화는 세포 배양육 생산의 효율성과 일관성을 유지하는 데 중요한 역할을 한다(Spiros et al., 2023). 이러한 환경 요소들은 세포의 생존과 성장에 영향을 미치며, 생산 프로세스에서의 불안정성을 최소화하는 데 기여할 수 있다.
세포 배양육 환경에서의 오염은 세포주의 안정성과 생산물의 품질에 부정적인 영향을 미칠 수 있다(Lee et al., 2023). 생물학적 안전성을 확보한 프로토콜의 수립은 세포 배양육 생산의 성공을 보장하는 데 필수적이다(Chriki and Hocquette, 2020). 이러한 관리요소들을 종합적으로 고려한 프로토콜과 환경 제어는 세포 배양육 생산의 안정성과 효율성을 보장하며, 연구 및 응용 분야에서의 성공적인 세포 배양육 활용을 가능하게 할 것이다.
세포 배양육의 비약적인 기술 진보는 전통적인 가축에 의존한 축산물의 품질을 뛰어넘기보다는 저비용으로 식육과 유사한 단백질 급원을 획득하기 위한 방향으로 발전하고 있다. 미래 식량자원으로서 세포 배양육은 증가하는 인구에게 단백질 식품 자원으로서 식량안보 차원에서 접근하여야 하며, 이러한 측면에서 전통적인 축산업과의 경쟁관계보다는 상호보완적인 역할을 할 수 있도록 안전하고 위생적인 세포 배양육 프로토콜을 갖춰나가야 한다. 그럼으로, 세포 배양육 기술을 효율적으로 발전시키기 위해서는 정확하고 표준화된 프로토콜의 수립과 철저한 위생 관리가 필수적으로 진행되어야 한다.
따라서, 본 연구에서는 세포 배양육에 관한 프로토콜 및 중요한 위생 관리 요소에 대한 탐색을 통해 실험의 효율성과 결과의 신뢰성을 높이기 위한 지침을 제공하고자 한다.
근육 유래 세포 분리 프로토콜
근육 줄기세포는 활성화 여부에 따라 활성화된 근아세포(myoblast)와 비활성화된 근육위성세포(muscle satellite cells)로 나뉘어진다. 근육위성세포는 생장이 정지된 상태로, 근섬유의 기저판에 생착하여 존재하다가, 근육의 상처나 외부의 자극에 의해 활성화가 되면 활성화 상태인 근아세포로 분화를 한다(Cossu and Biressi, 2005). 이 근아세포가 분열 및 분화 과정을 거쳐 근육 조직을 형성하는 것으로 알려져 있으며, 세포 배양육의 생산도 이러한 근육위성세포를 근섬유로부터 분리해내는 것으로부터 시작된다(Guo et al., 2022). 따라서, 이러한 근섬유 조직 내에 있는 근육 줄기세포를 효과적으로 분리하는 공정이 필요하다.
많은 연구들에서 물리적인 처리를 통해 근육 조직을 파쇄한 후, 다양한 단백질 분해 효소를 이용하여 근육 조직으로부터 근육 줄기세포를 분리하고 있다(Lee et al., 2021; Yun et al., 2023). 사용하는 단백질 분해효소의 종류와 농도, 처리 시간에 따라 근육 줄기세포 분리 효율이 달라질 수 있다. Table 1에 나와 있듯이, trypsin, collagenase, pronase, dispase 등 다양한 단백질 분해효소들이 근육 줄기세포 분리에 사용되고 있다.
| Enzymes | Species | References |
|---|---|---|
| Single | ||
| Trypsin | Rat, rabbit, cattle, chicken, pig, human | Coleman and Coleman (1968), Gospodarowicz et al. (1976), Miersch et al. (2018) |
| Dispase | Mouse | Suzuki et al. (2015) |
| Pronase | Rat, chicken, pig, cattle | Allen et al. (1980), Choi et al. (2020), Dodson et al. (1987), Ryu et al. (2023) |
| Collagenase | Mouse (Type I, II), pig (Type IV), cattle (Type II) | Figeac and Zammit (2015), Motohashi et al. (2014), Redshaw and Loughna (2012) |
| Mixed | ||
| Trypsin + Collagenase | Rat, Mouse | Che et al. (2011), Dai et al. (2015), Zhang et al. (2022) |
| Dispase + Collagenase | Mouse, rat, pig, human | Charville et al. (2015), Chen et al. (2023), Contreras et al. (2018), Ding et al. (2017), Düsterhöft et al. (1990), Shahini et al. (2018), Zhu et al. (2022) |
| Dispase + Collagenase + DNase | Mouse | Pannérec et al. (2013) |
| Trypsin + Collagenase + DNase | Pig | Perruchot et al. (2012) |
| Trypsin + Dispase + Collagenase | Mouse | Matthias et al. (2018) |
Trypsin은 이자(췌장)에서 분비되는 단백질 분해효소로서 펩타이드 아미노산 서열 중, 아르기닌(arginine)과 라이신(lysine)의 말단을 가수분해하는 기작을 지닌 것으로 알려져 있다(Ma et al., 2005). Trypsin은 배지에 첨가되는 혈청에 의해 단백질 분해 활성을 억제할 수 있는 특징을 갖고 있다. 이러한 trypsin을 활용하여 rat, rabbit, cattle, chicken, pig, human 등 다양한 종의 근육 줄기세포를 분리하는 연구가 진행되어 왔다(Coleman and Coleman, 1968; Gospodarowicz et al., 1976; Miersch et al., 2018). Pronase는 Streptomyces griseus균의 효소 제제로서 중성 및 알칼리성 protease, aminopeptidase, carboxypeptidase의 혼합물로 구성되어 있다. 비 특이적인 아미노산 서열을 분해하는 것으로 알려져 있으며, 조직을 해리하는 데 널리 사용되는 효소 중 하나이다(Proctor et al., 2019). Pronase는 trypsin보다 빠르게 가수분해를 진행하고, 큰 세포 덩어리 없이 세포 현탁액을 생성할 수 있으며, 죽은 세포와 세포 파편을 소화하는 능력이 탁월하다. 하지만, trypsin과 같이 혈청에 의해 단백질 분해 활성이 억제되지 않기 때문에 세포에서 pronase를 제거하는 과정이 필요하다. 이러한 pronase를 활용하여 rat, chicken, pig, cattle 등의 근육 줄기세포를 분리하는 연구가 보고된 바 있다(Allen et al., 1980; Choi et al., 2020; Dodson et al., 1987; Ryu et al., 2023). Dispase는 Bacillus polymyxa의 배양 여액에서 분리된 중성 단백질 분해효소로서 주로 세포외기질 단백질인 피브로넥틴(fibronectin)과 4형 콜라겐(type Ⅳ collagen)을 분해하고, 1형 콜라겐(type Ⅰ collagen)을 일부 분해할 수 있는 것으로 알려져 있다. 하지만, 라미닌과 5형 콜라겐(type Ⅴ collagen)에 대한 분해능은 없다(Stenn et al., 1989). Dispase를 활용한 근육 줄기세포의 분리 연구는 mouse 연구에서 보고된 바 있다(Suzuki et al., 2015). Collagenase는 천연 삼중 나선 형태인 콜라겐의 펩타이드 결합을 절단하는 단백질 분해효소로서, 특히 ‘프롤린(proline)-중성 아미노산-글리신(glycine)-프롤린’을 특이적으로 분해하는 기작을 갖고 있다(Van Wart and Randall Steinbrink, 1981). Collagenase는 Clostridium histolyticum으로부터 추출되어 사용되고 있으며, collagenase Ⅰ, Ⅱ, Ⅲ, Ⅳ, Ⅴ 등 다양한 형태의 collagenase가 mouse, pig, cattle의 근육 줄기세포 분리 연구에 사용되고 있다(Figeac and Zammit, 2015; Motohashi et al., 2014; Redshaw and Loughna, 2012).
이러한 단백질 분해효소들은 서로의 기질 특이성이 다르고, 활성이 다르기 때문에, 서로 상호보완적인 관계가 될 수 있다. 따라서, 많은 연구들에서 하나의 단백질 분해효소만을 사용하는 것이 아니라, 다양한 효소들을 복합적으로 사용함으로써 근육 조직으로부터 근육 줄기세포의 분리를 보다 더 효율적으로 진행하고 있다. Matthias et al.(2018)의 연구에서는 mouse로부터 muscle derived stem cell을 분리하기 위하여 파쇄된 뒷다리 근육에 collagenase, dispase, trypsin을 순차적으로 처리하여 세포를 분리하였다. Zhang et al.(2022)의 연구에서는 두 종류 타입의 collagenase를 활용하여 mouse로부터 근육 줄기세포를 분리하였다. 먼저 type Ⅱ collagenase로 1차적으로 분리를 하고, 원심분리를 한 뒤, 2차로는 type Ⅰ collagenase로 2차 분리를 실시하였다. 마지막으로 원심분리 후, trypsin을 처리하여 최종적인 근육 줄기세포를 분리하였다. 이처럼 순차적으로 단백질 분해효소를 사용하여 근육 줄기세포를 분리하는 경우, 각 단백질 분해효소마다의 최적의 조건을 설정해 줄 수 있기 때문에 분해 효율이 좋을 수 있는 장점이 있으나, 시간적인 측면에서 반응시간이 길다는 단점이 있을 수 있다. 따라서, 다양한 효소들을 동시에 처리하는 연구들도 보고되고 있다. Zhu et al.(2022)의 연구에서는 collagenase D와 dispase를 동시에 처리하여 돼지 근육 조직으로부터 근육 줄기세포를 분리하는 연구를 진행하였다. Contreras et al.(2018)와 Chen et al.(2023)의 연구에서도 collagenase와 dispase를 동시에 처리하여 근육 줄기세포의 분리 시간을 45, 90분으로 설정하여 연구를 수행하였다. 이처럼, 근육을 얻는 가축의 종과 얻는 근육의 부위에 따라서 근육 줄기세포를 해리하는 데 필요한 최적의 효소를 찾는 연구가 필요할 것으로 판단된다. 또한, 단일 효소 처리 및 복합 효소 처리에 따른 영향과 각 효소 반응의 최적의 조건을 찾는 연구가 수반된다면 보다 효율적인 근육 줄기세포의 확보가 가능할 것이다.
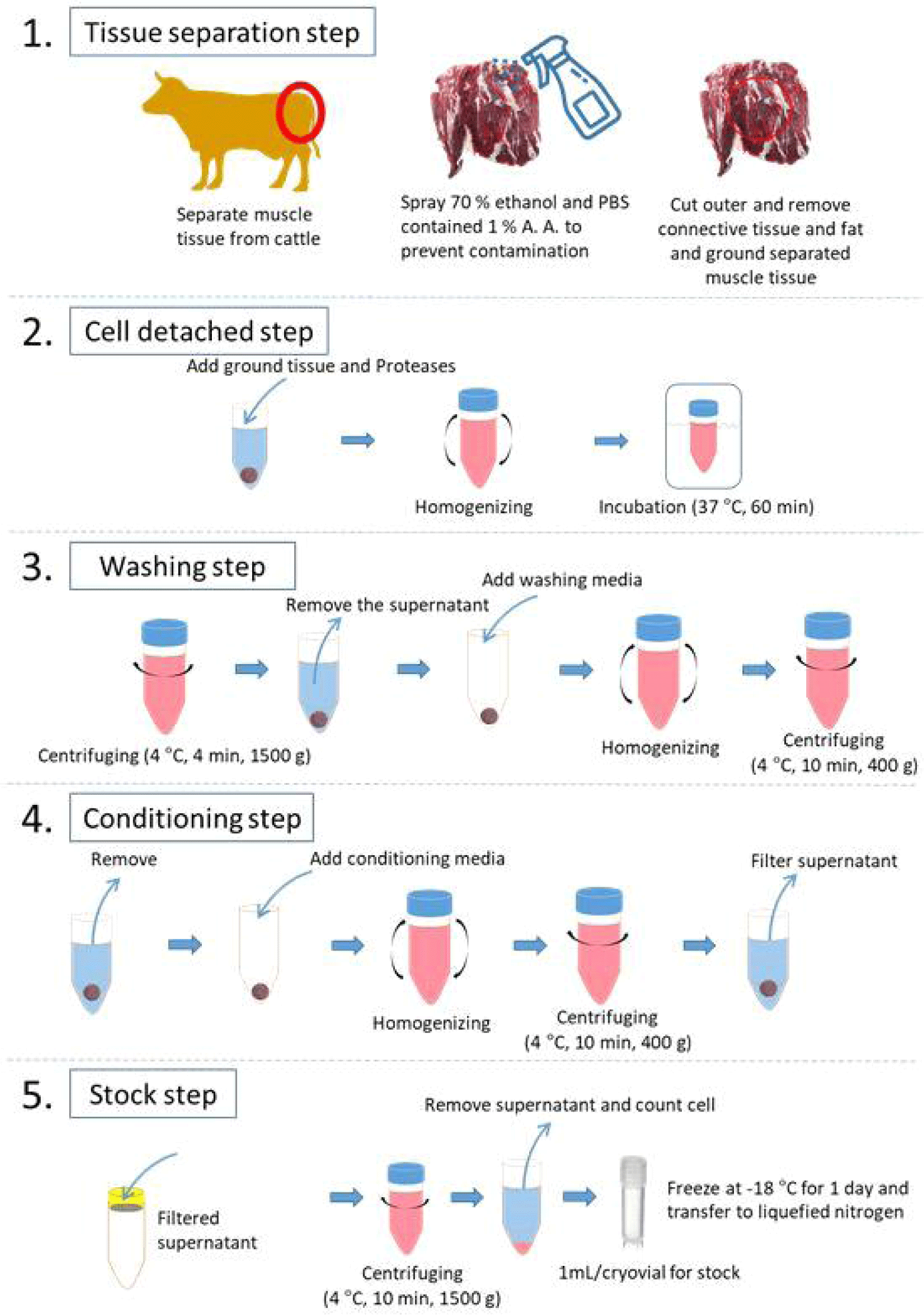
위와 같은 단백질 분해효소를 포함하여 근육으로부터 근육 세포를 분리하는 연구들이 다수 보고되고 있다(Lee et al., 2021; Li et al., 2022; Sesillo et al., 2020; Yun et al., 2023; Zhu et al., 2022). 해당 연구들을 요약하면, 근육 유래 세포 분리 단계는 크게, 1) 근육 조직으로부터 세포를 효율적으로 획득하기 위하여 조직을 잘게 분쇄하는 단계, 2) 근육 세포를 분리하기 위하여 단백질 분해효소와 반응하는 단계, 3) nylon mesh 및 cell strainer를 활용한 filtering 단계로 나눌 수 있다. 본 연구에서는 해당 단계들을 조금 더 세분화하여 5단계로 구분하였으며 자세한 설명은 Fig. 1과 같다.
근육 줄기세포 분리 프로토콜에서 해당 단계를 제외하고는 클린벤치 내에서 진행되는 작업이기에 첫 단계인 tissue separation 단계에서의 미생물 오염에 대한 예방은 매우 중요한 문제이다. 따라서, 도축된 가축으로부터 근육 부위를 취하여 70% 에탄올 스프레이를 이용해 근육을 소독하는 과정을 거친다. 이 과정에서, 세포 배양에서 주로 사용되는 항생제인 1% antibiotic-antimycotic이 함유된 PBS를 함께 사용해줌으로써 미생물 오염을 예방할 수 있다. 에탄올을 이용하여 소독한 근육 표면을 수술용 가위를 이용하여 제거하고, 근육 내 존재하는 결체조직과 지방을 함께 제거해준다. 마지막으로 근육 조직으로부터 근육 줄기세포의 해리가 효과적으로 일어날 수 있도록 근육을 잘게 파쇄해 주는 과정을 진행한다.
잘게 파쇄된 근육 조직을 50 mL tube에 단백질 분해효소와 함께 넣고 혼합해 준다. 37℃ water-bath에서 60분간 반응하여 근육 조직으로부터 근육 줄기세포를 해리하는 과정을 진행한다. 이때, 20분마다 tube를 교반시켜줌으로써 단백질 분해효소의 작용이 효과적으로 진행될 수 있도록 한다.
근육 조직으로부터 근육 줄기세포 해리를 마친 후, 사용한 효소를 제거하기 위하여 washing media(1% antibiotic-antimycotic in DMEM or PBS)를 이용해 수세하는 단계를 진행한다. 먼저, 원심 분리(1,500×g for 4 min, at 4℃)를 실시하여 상층액을 제거해준다. 다음으로 washing media를 처리하여 교반시킨 뒤, 원심 분리(400×g for 10 min, at 4℃)하고 상층액을 제거해주는 단계를 2회 반복해서 실시한다.
다음은 해리된 세포를 획득하기 위하여 20% FBS가 포함된 conditioning media(20% FBS and 1% antibiotic-antimycotic in DMEM)를 이용한다. 전 단계에서 상층액이 제거된 침전물에 conditioning media를 첨가하여 잘 교반시켜 준다. 이후, 원심분리(400×g for 10 min, at 4℃)를 통해 근육 단백질 덩어리와 세포를 분리시켜 준다.
근육 세포를 획득하고, 사용하기 이전까지 stock을 보유하기 위한 단계로 이전 단계에서 얻은 상층액을 100 μm cell strainer를 이용하여 부유물을 제거해 준다. 이렇게 얻은 근육 세포가 포함된 상층액을 원심분리(1,500×g for 10 min, at 4℃)를 통해 cell pellet을 수득한다. 해당 cell pellet에 동결용 배지를 첨가하여 cryovial에 소분한 후, isopropanol으로 채워진 vial container에 넣어 딥프리져에 하루 동안 냉동하여 완만한 냉동이 이루어지도록 한다. 이후, 액체 질소 탱크에 보관하여 향후 실험에 사용할 수 있도록 한다.
세포 배양육 생산을 위한 중요관리요소 설정
세포 배양식품 생산을 위한 세포 분리단계 중 중요관리요소를 Fig. 2에 나타내었다. 생물학적으로 세포는 생명체의 가장 작은 단위이자, 모든 유기체의 구성요소로써, 생물이 살아가는 데 중요한 요소로써 작용한다. 세포 배양식품의 생산을 위해서는 primary cell을 획득하고 이를 관리하는 것이 가장 중요한 요소일 것이다. 가축으로부터 세포를 획득할 때, 가축의 연령, 성별, 부위 등도 중요하지만, 유전적인 안정성과 계대수 등 세포 자체의 특성도 중요한 요소로써 영향을 끼칠 수 있다(Reiss et al., 2021). 세포 배양식품을 생산하기 위하여 소나 돼지, 닭 등에서 조직을 획득하고 세포 배양식품을 생산하는 방법은 다양하게 나오고 있다. 또한 같은 축종이라 하더라도 품종이나 세포의 종류에 따라 증식 또는 분화능력이 다르게 나타나므로 세포를 분리하고 획득하는 방법이 다르게 된다(Jara et al., 2023). 그러나 이러한 세포를 획득하기 전에 알맞은 배양 방식과 세포의 오염 제어, 물리적 충격에 의한 세포의 파괴 등을 제어하지 않으면 추후에 생산 과정 중 전체 세포의 상태에 큰 문제를 일으킬 수 있다. 따라서 세포를 획득하는 각 단계별 위험요소를 제어하는 것이 중요하다. 따라서 본문에서 정리된 근육 유래 세포 분리 프로토콜을 기반으로 조직을 분할하고 세포를 분리하여 저장하기까지 단계별로 분류하여 위험요소를 화학적, 생물학적, 물리적으로 나누어 제어하고 관리해야 하는 요소를 정리하였다.
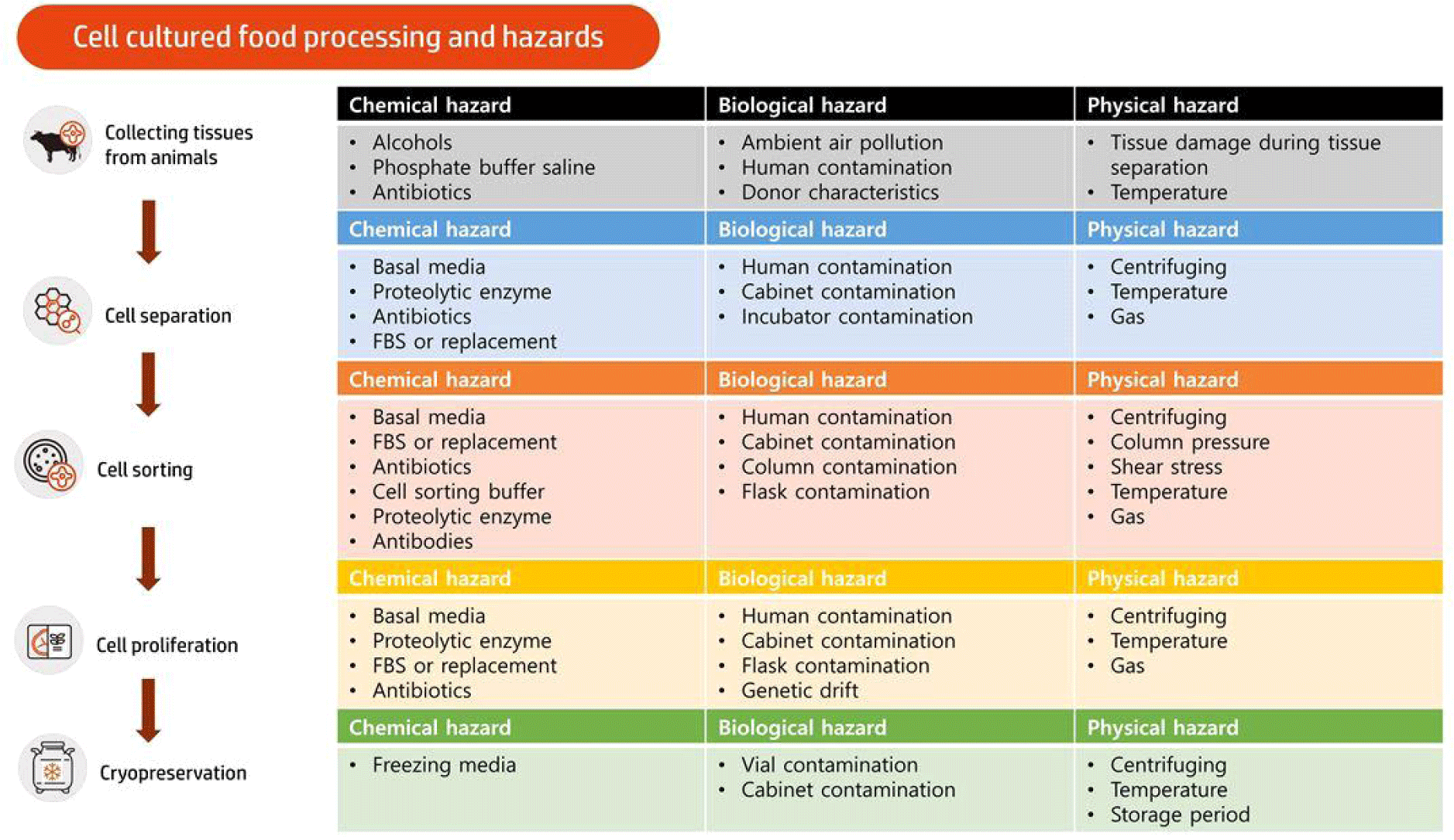
초기 조직에서 세포를 획득하고 세포 분리, 세포 분류 및 증식, 저장 등의 단계를 거치게 된다. 이러한 과정에서 미생물의 오염을 제어하기 위해, 알코올이나 버퍼에 함유된 화학물질 또는 basal media, 단백질 분해효소, 항생제, 소태아혈청 또는 기타 세포 성장 물질 등에 의한 화학적 위험 요소가 존재한다. 또한 세포를 분류하기 위하여 sorting buffer나 목적하는 세포에 붙이기 위한 항체 등을 사용하여 분류하게 되고, 저장 시 freezing media를 이용하여 세포를 저장하게 되는데 각 물질의 조성에 따라 세포는 영향을 받게 된다.
알코올의 경우 세포막을 파괴시켜 세포의 생존률을 하락시킬 수 있다(Wu and Cederbaum, 2003). 또한 삼투압 차이에 의한 세포의 파괴를 억제시키기 위하여 생리식염수를 사용하여 세척을 실시하는데 이때 사용되는 염의 농도와 독성 효과에 의해서 세포도 영향을 받게 된다. 일반적으로 세포 생장 중에 세포 독성이 낮은 Dulbecco’s phosphate buffered saline(DPBS)을 사용하는데, DPBS 안에 항생제를 포함하여 조직 해체 중에 발생하는 오염을 방지한다. 그러나 항생제는 세포의 미토콘드리아의 기능 장애를 유도하고 세포의 산화 스트레스를 유발하여 장기간 사용시 세포 자체의 기능을 상실할 수 있다고 알려져 있다(Kalghatgi et al., 2013). 또한 페니실린과 같은 항생제는 간에서 대사가 이루어지는데, Human HepG2 등의 간세포 배양 시 유전형 발현과 조절에 영향을 준다고 알려져 있다(Ryu et al., 2017). 현재까지 항생제가 세포에 미치는 확실한 메커니즘이나 줄기세포 등에 미치는 정확한 영향력은 알려져 있지 않지만, 그 사용에 있어서 세포 자체의 유전자 발현에 문제점을 일으키지 않도록 지속적인 관찰이 필요할 것이다. 또한 세포를 분리하는 도중 단백질 분해효소에 의해 세포막 내 존재하는 단백질이 분해되어 획득하려는 세포에 영향을 끼칠 수 있다(Choi et al., 2021). 따라서 사용함에 있어 적절한 농도와 시간을 준수하여 세포에 부정적인 영향을 끼치지 않도록 주의가 필요하다. 세포 배양 시 이용되는 소태아혈청은 200–400개 이상의 단백질을 포함하고 여러 작은 대사물질들을 포함하여 세포의 성장에 필수적인 요소로 작용한다(Post et al., 2020). 그러나 소태아혈청의 높은 가격에 의해서 세포 배양식품의 가격을 낮추기 어려워 serum-free medium을 활용한 세포배양 또는 기타 소태아혈청의 대체 연구가 활발히 되고 있다(Lee et al., 2022). 최근에는 소태아혈청 외에도 세포 배양식품 내에 사용될 수 있는 각종 세포 배양물질 대체재 또한 연구되고 있으나, 세포마다 그 특성이 현저히 달라 완벽하게 대체할 수 있는 기술은 전무하다(Lee et al., 2022). 또한 세포를 분류하기 위하여 sorting buffer나 항체 등을 사용하여 분류하게 되는데, 이것으로 인해 세포의 증식 및 분화가 영향을 받을 수 있다(Allen and Boxhorn, 1989; Fillinger et al., 1993). 마지막으로, 세포를 장기간 저장하기 위해서 일반적으로 freezing media를 사용하여 저장하게 된다. 일반적으로 dimethyl sulfoxide(DMSO) 등을 섞어 사용하나, 일부 세포는 낮은 DMSO 농도에서도 사멸할 수 있다(Kang et al., 2017). 따라서 세포의 사멸을 늦출 수 있는 적절한 농도에서 사용하여 저장해야 할 것이다.
화학성분 외에도 조직 분할 시 조직이 공기 중에 노출됨에 따라 부유 미생물 또는 사람이나 가축에서 교차오염되는 경우도 발생할 수 있다. 따라서 이러한 분리 과정 중에 발생하는 오염을 방지해야 한다. 예를 들어 도축 후에 조직을 획득할 경우, 도축장의 위생 상태나 조직을 옮기는 동안에 발생하는 교차 오염 등을 방지해야 한다. 또한 살아있는 동물에게서 조직을 떼어낼 때 사용되는 칼날이나, 떼어내는 도중 다른 부위로부터 오염되는 것을 방지해야 한다. 또한 세포를 분리하고 관리하는 도중 세균, 곰팡이, 효모, 바이러스, 미코플라스마 등에 의한 생물학적 오염 등은 추후 교차 오염의 위험성이 있으므로 초기에 제어해야 한다. 대부분 과정에서 사람에 의한 오염이 문제될 수 있으며, 사용되는 멸균대나 생물안전작업대 또는 세포를 키우는 플라스크, 배양기, cryovial 등의 오염에 의해 문제가 될 수 있다. 이러한 외부 오염 외에도 세포의 유전적 변이 가능성을 주의해야 할 것이다(Spiros et al., 2023). 세포주 생산을 위한 과정 중 발생할 수 있는 유전적 변이는 세포배양물을 식품으로 이용할 때 가장 주의해야 할 부분이므로 증식 과정 중 유전적 변이가 일어나지 않도록 세포주에 대한 지속적인 관리가 필요할 것이다(Spiros et al., 2023).
조직을 해체하는 동안 발생하는 물리적인 요소 또한 세포 분리과정 발생하는 중요한 위험요소이다. 공기 중 조직의 노출에 의한 산화 또는 저장기간이 지남에 따른 조직의 사멸도 중요한 요소이지만 조직을 분리하는 도중 발생하는 충격이나, 주변 온도에 의한 조직의 파괴 등도 세포 분리 시 중요한 관리요소이다. 또한 물리적인 충격에 의해서 세포가 영향을 받을 수 있다. 세포를 조직에서 분리하고 저장하는 과정 중에 원심분리, 온도 등에 의해서 세포막이 변형되어 파괴될 수 있다. 또한 인큐베이터 내에 조성되는 가스에 의해서도 세포의 유전 발현에 영향을 받게 되므로 세포 배양에 목적하는 바에 따라 인큐베이터 조성 가스 또한 조절해야 할 것이다(Zhong et al., 2011). 세포를 분리하는 도중 발생하는 외부 압력에 의한 세포 파괴 등 물리적인 힘에 의해서도 세포가 영향을 받을 수 있다. 따라서 목적하는 세포를 분류하기 위하여 세포의 파괴를 관리하며 진행해야 할 것이다. 분리 후 세포를 저장할 때에도 저장 온도 또는 저장 기간에 의해서도 추후 세포가 영향을 받을 수 있으므로 지속적인 관리가 필요할 것이다(McGann et al., 1988; Merivaara et al., 2021).