Research Article
돼지 부산물에서 담즙산의 활용
김온유1
,
이다영1
,
이승연1
,
강지협1
,
김재현1
,
김현우1
,
오동훈1
,
정재원1
,
허선진1,*
Development of bile salt in pig by-products
On You Kim1
,
Da Young Lee1
,
Seung Yun Lee1
,
Ji Hyeop Kang1
,
Jae Hyeon Kim1
,
Hyun Woo Kim1
,
Dong Hoon Oh1
,
Jae Won Jeong1
,
Sun Jin Hur1,*
Author Information & Copyright ▼
1Department of Animal Science and Technology, Chung-Ang University, Anseong 17546, Korea
*Corresponding author : Sun Jin Hur. Department of Animal Science and Technology, Chung-Ang University, Anseong 17546, Korea. Tel: +82-31-670-4673, Fax: +82-31-670-3108, E-mail:
hursj@cau.ac.kr
© Copyright 2021 Korean Society for Food Science of Animal Resources. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jun 21, 2021; Revised: Jun 28, 2021; Accepted: Jun 28, 2021
Published Online: Jul 31, 2021
Abstract
This review provides an overview of the use of pig by-products such as bile salt and their originated bioactive compounds. Pig by-products also increase in production as consumption of meat increases every year, but due to the high cost of processing and the large imbalance in supply and demand over the season, they also change significantly and rely on imported by-products with low price fluctuations. For this reason, a large amount of domestic pork by-products that are not consumed are being discarded. Several studies have conducted to developing the bioactive material such as chenodeoxycholic acid (CDCA) and synthesis of ursodeoxycholic acid (UDCA) from pig by-products. CDCA can be extracted from bile salt in mammals and used as precursors to synthesize UDCA. UDCA is well known as the gallbladder component of bear, and it is used as an improvement in liver function in Korea and the eastern countries. Therefore, gallbladder, which is a by-roduct of pig slaughter, will be available as a material for acquiring bioactive compounds such as UDCA.
Keywords: pig slaughter by-product; bile salt; chenodeoxycholic acid; ursodeoxycholic acid
서 론
주산물인 식육을 생산하기 위해 도축장에서 생축을 도살, 해체하는 과정에서 불가피하게 얻어지는 부분을 부산물이라 하며, 돼지를 도축할 때 나오는 부산물에는 혈액, 뼈, 껍질, 족, 머리 및 내장 등이 있다(Toldrá et al., 2016). 내장은 부산물 중 가장 많은 부분을 차지하는데, 내장은 횡격막을 중심으로 적내장(간, 심장, 허파)과 백내장(위, 소장, 대장)으로 구성된다. 돼지 부산물의 생산 및 가공 과정은 다음과 같다. 먼저 방혈을 통하여 혈액을 획득하고, 머리는 절단하여 잔모를 제거하는 과정을 거친다. 백내장은 분리 후 분변을 제거한 후 세척과 탈수 과정을 거치고, 적내장의 경우 분리 후 세척과 탈수 과정을 거쳐 획득한다. 위와 같은 돼지 부산물은 매년 식육의 소비가 증가함에 따라 생산량도 같이 증가하고 있다. 그러나, 부산물의 처리 및 가공 비용의 증가와 계절에 따른 수급 불균형의 문제점으로 인해, 상대적으로 가격이 안정한 수입 부산물로 수요를 충족하고 있는 실정이다. 이러한 이유로 소비가 이루어지지 않는 국내산 돼지 부산물은 많은 양이 폐기되고 있는 실정이다. 따라서 본 연구에서는 돼지 부산물 중에서 활용가능성이 낮은 담즙산의 이용 가능성을 조사함으로써 돼지 부산물의 활용도를 증대시키는 것이 목표이다. 뿐만 아니라 돼지 부산물에서 곰의 웅담 성분으로 잘 알려진 ursodeoxycholic acid(UDCA)를 획득하기 위해 돼지 담즙산에서 chenodeoxycholic acid(CDCA)를 추출하고, CDCA를 이용하여 UDCA를 합성하는 실험과 관련된 연구들을 조사하였다.
돼지 부산물의 이용
돼지 부산물은 대부분 식품 재료로 사용되는데 돼지 소장의 경우 순대 또는 소시지 케이싱으로 많이 이용되고, 혈액의 경우 순대나 유럽 국가에서 블러드소시지(혈액소시지)를 제조하는 형태로 소비되고 있다. 그러나 내장 부산물은 특유의 냄새가 강하여 기호성이 크지 않기 때문에 다른 부산물에 비해 소비가 크게 떨어진다. 최근에는 돼지 부산물을 이용한 신소재 개발 연구가 많이 진행되고 있는데, 그 예로 단백질이 풍부한 혈액과 내장을 이용하여 생리활성 단백질을 추출하거나, 돈피를 이용하여 추출한 콜라겐 또는 젤라틴을 화장품 원료로 사용하고 있을 뿐만 아니라, 헤파린을 추출하는데 혈액 등이 일부 사용되고 있다(Di Bernardini et al., 2011; Jayathilakan et al., 2012; Lafarga and Hayes, 2014; Mora et al., 2014; Toldrá et al., 2012). 또, 돼지 담낭인 저담은 적은 양이지만 약재로도 이용되고 있다(Lee and Kim, 2009; Seo et al., 2016).
담즙산
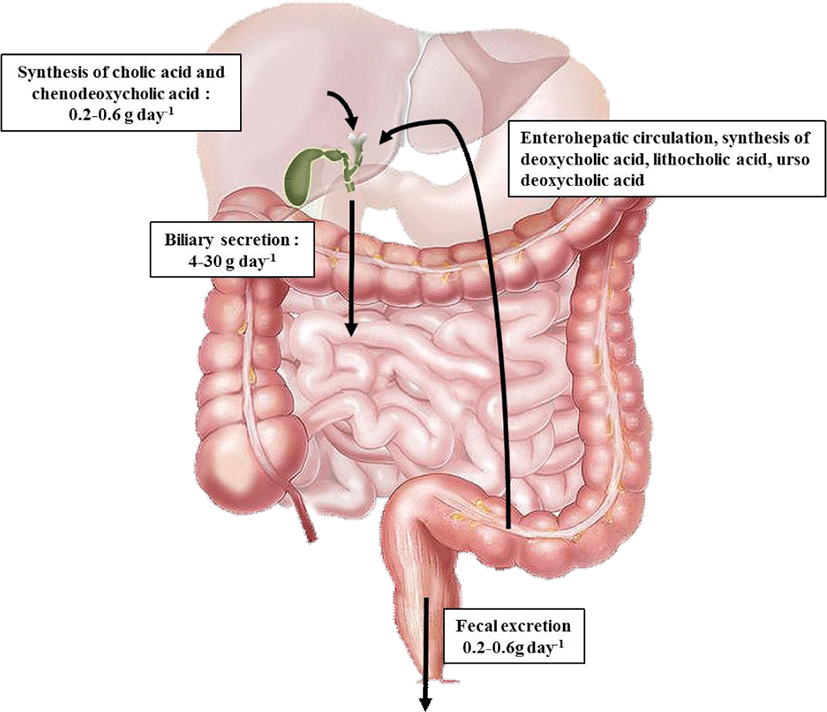
담즙산은 장에서 지질, 영양소 및 비타민의 흡수와 전달을 촉진할 뿐만 아니라, 담즙의 배출 유도, 담즙산 합성 피드백 제어 및 콜레스테롤의 배출에 작용하는 성분이다(Seol, 2002). 정상 성인은 일반적으로 하루 600–800 mL의 담즙을 생성하는데, 이 중 80%가 수분이며, 나머지 20%는 담즙산(65%), 인지질(20%), 단백질(4%–5%), 콜레스테롤(4%), 빌리루빈(0.3%), 미량의 비타민 및 호르몬 등으로 구성되어 있다(Agellon, 2002). 담즙산은 나트륨, 칼륨 같은 염들과 결합되어 존재하며, micelle을 형성하여 지용성 콜레스테롤을 용해한다(Moghimipour et al., 2015; Stamp and Jenkins, 2008). Fig. 1에 나타낸 바와 같이 담즙산은 그 대부분이 하루 3–15회의 장간 순환되며, 소화기관으로 약 15–17 g이 배설되고, 대변을 통해 하루에 약 0.5 g 정도가 체외로 배설된다(Yoon, 2004). 담즙산이 소변과 대변을 통하여 손실되면 콜레스테롤로부터 담즙산이 새로 합성됨으로써 그 함량이 일정하게 유지되는데, 이는 콜레스테롤을 제거하는 주요 경로이다(Tsai et al., 2011). 그뿐만 아니라 담즙의 장간 순환은 간세포에서의 능동적인 흡수와 분비 및 장 상피세포에서의 능동적인 흡수에 의하여 조절된다(Albano et al., 2012; Feher, 2012; Shneider, 2001).
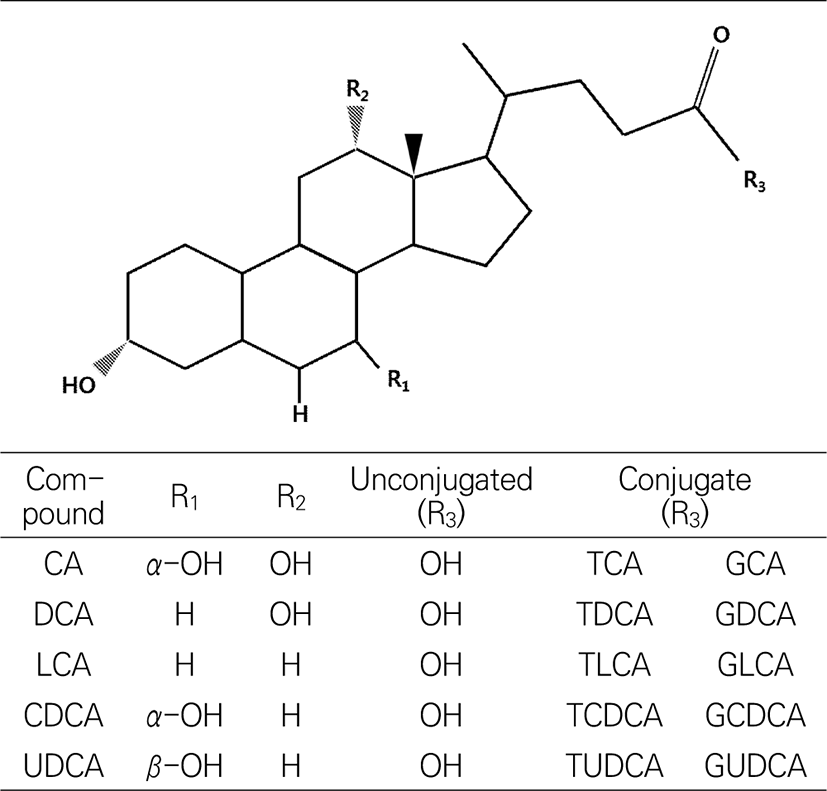
담즙산의 생성과 구조
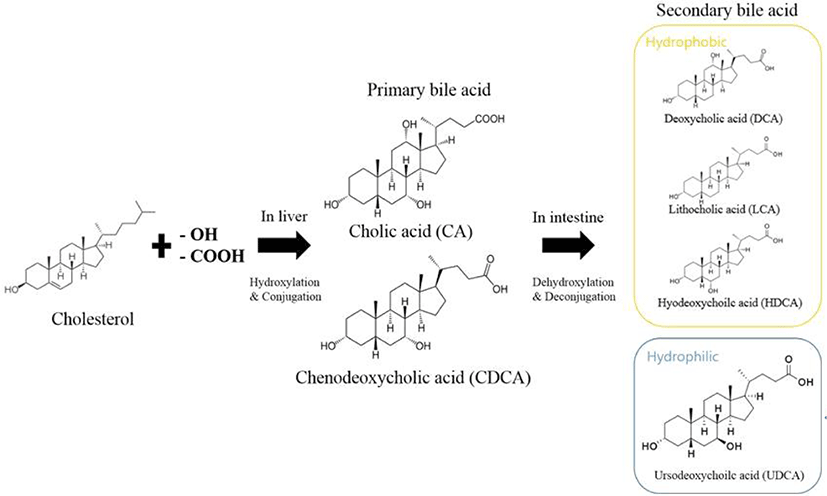
담즙산은 간장에서 지용성 콜레스테롤이 변형되어 수용성기가 증가하게 되어 친수성과 소수성을 모두 가지고 있는 비포합 담즙산 형태로 합성된다. 이렇게 간에서 생성된 담즙산은 1차 담즙산이라 불리며, 담낭에서 글리신과 타우린이 결합하여 담즙산염(포합 담즙산) 형태로 저장 및 농축된다(Bang et al., 2011). 글리신 결합 담즙산염은 타우린 결합 담즙산염에 비해 3배 가량 많이 형성된다. 인체 내에서 생성되는 1차 담즙산으로는 cholic acid(CA)와 CDCA가 있으며, 십이지장으로 분비된 1차 담즙산은 장내세균의 탈수화 과정을 통해 2차 담즙산인 deoxycholic acid(DCA)와 lithocholic acid(LCA)로 변환된다(Fig. 2). 변환된 2차 담즙산은 주로 회장 말단부에서 1차 담즙산들과 함께 간으로 운반되는 장관 순환을 통해 재흡수된다(Fig. 3; Yang et al., 1998).
Fig. 3.
Structures of bile acids. CA, cholic acid; DCA, deoxycholic acid; LCA, lithocholic acid; CDCA, chenodeoxycholic acid; UDCA, ursodeoxycholic acid,
Download Original Figure
콜레스테롤로부터 합성되는 담즙산은 스테로이드에 속하는 hydrocarboxylic acid로 hydroxyl 기의 위치와 사슬 구조 등의 차이에 따라 그 종류가 나누어지는데, 생물 종에 따라 합성되는 종류에 차이가 있다. 담즙산의 구조는 담즙산의 유효성과 독성에 크게 영향을 미치는 요소이며, 수용성 또는 지용성을 나타내고, 이로 인해 고유한 생리적, 병리적 및 약리적 활성이 나타난다(Thomas et al., 2008). 담즙산 중에 가장 수용성이 큰 것은 UDCA, 작은 것은 LCA이며, CA와 CDCA는 중간 정도의 수용성을 나타낸다. 연구에 따르면 UDCA는 수용성이 높은 특징으로 인해, 세포 손상을 일으키는 자유 라디칼을 억제 효과가 있어 간 치료제로 사용될 수 있으나, LCA와 CDCA와 같은 지용성 담즙산은 세포막 지질을 용해시켜 간세포의 괴사를 유도한다고 보고되고 있다. 또한 DCA는 세포에 산화적 스트레스를 유발하여 염증 및 발암 가능성이 있다고 알려져 있다(Degirolamo et al., 2011).
돼지 담즙산
돼지 담즙산의 화학적 조성(Alvaro et al., 1986; Kuramoto et al., 2000; Lundell and Wikvall, 2008; Wang and Carey, 2014)은 Table 1에서 나타낸 바와 같이 hyodeoxycholic acid(HDCA)와 CDCA가 약 90%를 차지하고, hyocholic acid(HCA)가 약 6%를 차지하고 있으며, UDCA는 약 2%로 소량 존재하고 있다(Jirsa et al., 1989; Kasbo et al., 2002; Kibe et al., 1980; Oomen et al., 2004).
Table 1.
Major components of bile acid in pigs
| Bile acid |
Composition (%) |
Glycobile acid (%) |
Taurobile acid (%) |
Note |
| CDCA |
48 |
45 |
3 |
- |
| HDCA |
42 |
39 |
3 |
Major bile acids of pigs (In humans, DCA forms) |
| HCA |
6 |
5 |
1 |
Major bile acids of pigs (In humans, CA forms) |
| CA |
0.5 |
0.5 |
- |
- |
| DCA |
0.5 |
0.5 |
- |
- |
| LCA |
1 |
1 |
- |
- |
| UDCA |
2 |
1.8 |
0.2 |
- |
Download Excel Table
담즙산 추출
담즙산은 담낭에서 불순물을 제거한 후 30% 수산화나트륨을 이용하여 포합 담즙산을 120℃에서 8–12시간 이상 가수분해를 진행한 다음, 온도를 낮추고 pH를 감소시킨 뒤 유기용매를 첨가하여 회수하고 건조하여 획득할 수 있다. 이때 획득한 담즙산 혼합물은 유기 용매와 염산의 농도에 따라 분리할 수 있으며, CA의 경우 15% 염산에서 추출되고, CDCA와 DCA는 25% 염산에서 추출되며, LCA의 경우 진한 염산에서 추출되지 않는다. 이 방법은 수산기가 많은 담즙산일수록 묽은 염산으로 추출 가능하다는 성질을 이용한 담즙산 추출 방법이다(Wieland, 1966).
조직에서 담즙산 추출
간 100 mg에 10 mM phosphate buffer(pH 6.0) 900 µL를 넣어 균질기를 이용하여 2,000 rpm으로 3분간 균질화한다. 균질액을 상온에서 3시간 방치한 뒤 원심 분리를 이용하여 획득한 상층액에 acetonitrile 800 µL와 ammonium sulfate 20 µL 첨가를 통해 단백질을 침전 시켜 제거하고, 상온에서 진공상태로 건조하여 담즙산을 획득할 수 있다(Suzuki et al., 2013).
분변, 위장 또는 조직에 메탄올 또는 클로로포름과 같은 유기용매를 이용하여 지방 성분을 추출한 후 유기용매를 건조시킨다. 건조된 물질을 메탄올로 다시 수집하여 강한 수산화나트륨을 첨가한 뒤 고압고온에서 가수분해를 진행한 후 염산을 이용하여 pH 1.0으로 낮추면 담즙산이 침전된다. 이후 다시 에틸아세테이트를 첨가하여 에틸아세테이트 층을 별도로 수집하고, 60℃에서 진공농축하여 담즙산을 획득할 수 있다(Batta et al., 1998; Haslewood, 1978; Sharp et al., 1971).
담즙산 분석
담즙산은 구조와 성질의 유사성으로 인하여 이를 분석하기 위한 연구가 많이 진행되어 왔으며, chromatography를 이용한 방법뿐만 아니라, 더 높은 감도와 정확성을 위해 질량분석기 등을 이용한 연구가 진행되고 있다(Griffiths and Sjövall, 2010; Lee, 2016; Scalia, 1995; Setchell and Matsui, 1983; Sharma, 2012). 초기 담즙산 분석은 높은 감도를 가진 gas chromatography mass spectrometry(GC-MS)를 이용한 분석이 많이 진행되었지만(Batta et al., 1992; Batta et al., 1997; Batta and Salen, 1999; Grundy et al., 1965; Koopman et al., 1984; Setchell et al., 1983; Street et al., 1986; Tsai et al., 2011), 이후에는 가수분해 및 유도체화와 같은 복잡한 전처리 과정으로 인하여 liquid chromatography(LC)를 이용한 분석법이 발달되었을 뿐만 아니라, ultraviolet ray(UV)나 fluorescence를 결합한 형태의 기기를 분석에 활용하고 있다(Chang et al., 2003; Jones et al., 2003; Mukherjee and Pal, 2011). 그러나 담즙산은 분자 내에 강한 발색단(chromophore)이 존재하지 않아 감도가 낮고, 그에 따라 UV를 통한 분석에 한계가 있다. 최근에는 기존의 한계를 극복하기 위한 방법으로 high performance liquid chromatography-tandem mass(HPLC-MS/MS) (Alnouti et al., 2008; Burkard et al., 2005; Huang et al., 2011; John et al., 2014; Tessier et al., 2003)와 ultra-high performance liquid chromatography-tandem mass(UPLC-MS/MS) 등이 분석에 이용되고 있다(Suzuki et al., 2013).
Chenodeoxycholic acid (CDCA)
CDCA(3α, 7α-dihydroxy-5β-cholan-24-oic acid)는 거위의 담즙산에서 최초로 발견되었고, 거위나 오리와 같은 가금류의 담즙산에서 많은 비율을 차지하고 있으며, 사람에게는 1차 담즙산의 형태로 담즙산의 20%–30%를 차지하고 있다. CDCA는 간에서 콜레스테롤의 합성을 감소시켜 담즙 내의 콜레스테롤 분비를 감소시키거나, 장내에서 콜레스테롤의 흡수를 감소시켜 담즙 내의 콜레스테롤 포화도를 감소시키는 작용을 한다(Seol, 2002). 그러나 CDCA가 콜레스테롤의 용해도를 증가시키거나, 직접적으로 담석을 용해시키는 효과는 아직까지 명확하게 확인된 바가 없으며, CDCA와 UDCA를 같이 처리하였을 경우 콜레스테롤이나 담석을 용해시키는 효능이 보고되고 있다(Lee, 2001).
CDCA 추출
CDCA는 CA와 같이 UDCA 합성을 위한 스타트 물질로써 분리 및 추출되었다. CDCA의 경우, 거위 담즙산 함량 중 90% 이상을 차지하고 있기 때문에 거위 담즙산에서 많이 분리 및 추출되어 왔지만, 담낭의 크기가 매우 작고 거위의 소비량 또한 높지 않아 이외 오리, 닭 또는 돼지에서의 분리 및 추출이 많이 연구되었다. 돼지 담즙산에서는 담즙산을 가수분해한 후, 에스테르화, 비극성 유기용매를 이용한 중간 물질 제거와 유기용매 결정화 등 8단계를 거쳐 CDCA를 획득한다(Ziegler et al., 1980). 오리 담즙산은 60-65℃에서 1시간 동안 메탄올을 이용하여 용해시키고, 수산화나트륨을 첨가하여 가수분해를 진행한 뒤 염화칼슘을 첨가하여 CDCA calcium salt 침전물을 형성시킨다. 여기에 다시 산을 첨가하여 침전물을 용해하여 CDCA를 추출할 수 있다(Hu et al., 2018; Wan et al., 2012).
Ursodesoxycholic acid (UDCA)
UDCA(3α,7β-dihydroxy-5β-cholan-24-oic acid)는 1902년 북극곰의 담즙에서 처음 발견되었고(Hammarsten, 1902), 1927년 Okayama 대학에서 중국곰 담즙으로부터 처음 동정되었으며, 이때부터 ursodesoxycholic acid라는 명칭으로 불리게 되었다(Shoda, 1927). UDCA는 1936년에 화학식이 규명되었고(Iwasaki, 1936), 1954년에 경제적이고 효율적인 UDCA 합성법이 발견되었으며(Kanazawa et al., 1954), 1957년 동경의 Tanabe 제약회사에서 처음으로 담즙산 제제로 시판되어 다양한 간 담도 및 소화기 질환에 이용되어 오고 있다. 1961년에는 UDCA가 만성간염 환자에 효과가 있음이 보고되었고(Ichida, 1961), 콜레스테롤 담석의 용해 치료에 UDCA가 효과적이라는 연구가 보고되었다(Makino et al., 1975). 또한 뉴트리아에서 높은 함량의 UDCA가 발견되어 많은 연구자들이 연구를 진행하고 있으며(Tint et al., 1986), UDCA는 일반적으로 성인 담즙산의 1%–2%를 차치하는데, UDCA를 투여한 2주 후에는 55%–60%까지 증가할 수 있다(Seol, 2002).
UDCA 효능
곰의 담즙은 ‘웅담’으로 알려져 중국 전통의학에서 수 천 년간 약재로 쓰여 왔으며(Feng et al., 2009), UDCA는 국내에서도 한약재로 사용되며, 간, 담도 질환 및 소화계 이상, 피부질환, 임신중독 또는 식중독 등의 여러 가지 병의 치료제로 사용되고 있다(Lee, 1995). UDCA는 고농도 소수성 담즙산에 의한 간 손상 및 담즙 정체를 줄이기 위해 사용될 수 있으며(Nobilis et al., 2001), UDCA와 CDCA를 담석을 가진 환자의 치료제로 투여할 경우, cholesterol을 효과적으로 감소시키는 것으로(Lee, 1995) 보고되었다. 뿐만 아니라 UDCA는 담석 형성을 감소시키는데, 이는 간 내로 분비되는 콜레스테롤을 감소시키면서 인지질의 분비를 증가시키는 dual mechanism을 통해 나타나는 것으로 보고되었다. 최근에는 rarnesoid X receptor(FXR), gprotein-coupled bile acid receptor(GPBAR1 also known as TGR5), vitamin D receptor(VDR), pregnane X receptor(PXR)와 같은 nuclear receptor의 ligand 및 signaling factor 기능에 미치는 UDCA의 작용이 밝혀지면서 더욱 그 중요성이 대두되고 있다(Beuers et al., 2015; Kotb, 2012; Lazaridis et al., 2001).
UDCA 합성
화학적 UDCA 합성
UDCA는 대부분 전구물질이 될 수 있는 거위 및 소 담즙과 같이 담즙 함량이 높은 원료로부터 대량으로 제조되어 왔으며, CA를 스타트 물질로 이용한 합성이 제일 먼저 개발되었다(Hofmann, 1963; Kanazawa et al., 1954). 이 합성 방법은 소의 담낭에서 CA를 추출한 후 C-12 위치의 -OH를 제거하여 CDCA를 합성하고, 다시 C-7 위치의 -OH를 산화, 환원 반응을 거쳐 UDCA를 합성한다. CA에서 UDCA를 합성하는 방법은 C-12 위치의 -OH의 제거가 필수적이지만, 그 방법인 Wolff-Kishner 환원 반응에서 카보닐기를 제거할 때 200℃ 이상의 고온을 유지해야 하기 때문에 안정성에 위험이 있고 수율이 낮다. 또한 담낭의 크기가 크고 CA의 함량이 높은 소에서 CA를 원료로 얻을 수 있지만, 소 담낭은 우황청심원과 같은 한방 약제 생산에 많이 이용되고 있다. 이로 인해 최근 CDCA를 스타트 물질로 이용하여 UDCA를 합성하는 방법이 많이 연구되고 있다. CDCA와 UDCA의 합성 중 중간물질인 7-ketolithochloic acid에 나트륨 금속 외에도 납, 니켈 등과 같은 금속을 이용한 환원이 진행되었으며(Tian et al., 2013; Yuan et al., 2014; Zhao et al., 2010), 다른 담즙산(LCA, HDCA)으로부터 UDCA를 합성하는 방법도 연구되고 있다(Dou and Jiang, 2016; Zhou et al., 1990).
산화, 환원방법을 통해 얻은 CDCA와 UDCA mixture는 정제하여 UDCA만을 획득할 수 있다. UDCA 정제는 CDCA와 UDCA mixture 0.1 g에 dimethylformamide(DMF) 1 mL와 hexamethyldisilazane(HMDS) 0.1 mL를 넣고 교반기를 이용하여 60℃에서 250 rpm으로 반응시킨다. 이후 0℃에서 12시간 방치하여 생성된 결정화 물질을 상온에서 건조하고, 8% HCl을 첨가한 후 50℃에서 2시간 반응시키면 UDCA를 획득할 수 있다(Ma and Cao, 2014). 또한 정제 과정에서 실리레이션 반응을 이용한 방법이 아닌 다른 유기체를 이용하는 방법도 연구되고 있다(Ziyun, 2008). 그러나 이러한 화학적 방법의 합성은 독성이 있는 유기용매 사용의 위험이 있고, 금속 이온 사용으로 폭발의 위험성이 있으며, 유도체 생성 단계별로 다른 유기체가 생성되기 때문에 정제가 필수적으로 요구된다.
효소적 UDCA 합성
효소적 UDCA 합성은 미생물의 특정 효소를 추출하여 합성하는 것이다. CA에서 UDCA를 합성할 경우 12α-hydroxysteroid dehydrogenase(12α-HSDH), 7α-HSDH 또는 7β-HSDH와 같은 효소가 요구된다. 이러한 효소는 Clostridium group P(Braun et al., 1991), Xanthomonas maltophilia(Pedrini et al., 2006) 또는 Fusarium equiseti M41(Sawada et al., 1982) 등 많은 미생물(Baron et al., 1991; Hirano and Masuda, 1982; Macdonald et al., 1982; Zheng et al., 2018)에서 추출하는 방법이 연구되고 있다. 효소적 합성 방법은 앞서 설명한 화학적인 합성 방법보다 독성에 대한 우려가 적고, 금속 이온을 사용하지 않아 폭발의 위험이 없으며, 원하는 담즙산을 특이적으로 합성할 수 있다는 이점이 있다. 그러나 아직까지 대량 생산이 용이하지 않고, 조효소가 필요하다는 단점이 있다(Eggert et al., 2014; Tonin and Arends, 2018).
Bile salt hydrolase (BSH) 효소
Bile salt hydrolase(BSH) (E.C.3.5.1.24) 효소는 스테로이드 부분 C-24 위치와 담즙산의 아미드 결합 부위에 가수분해를 촉매하는 효소로 choloylglycine hydrolase 효소군에 속한다(Chand et al., 2017a; Ridlon et al., 2006). 담즙산염은 회장 말단과 결장에 들어갈 때 BSH 효소로 알려진 bacterial 효소에 의해 분해되며, 타우린과 글리신 접합체에 대해 친화성을 가진다. 특히 타우린 결합 담즙산염보다 글리신 결합 담즙산염을 가수 분해하는데 더 높은 활성을 나타낸다. BSH 효소는 다양한 장내 미생물에서 얻을 수 있는데, 효소 활성, 기질특이성, 최적온도 및 pH가 다양하며(Begley et al., 2006), BSH 효소의 분자량은 28–50 kDa이다. BSH 효소 활성을 위한 최적의 pH는 3.5–6.0으로 약산성을 띄며, 37℃–60℃에서 높은 활성을 나타낸다. BSH 효소는 프로바이오틱스의 능력을 가질 뿐만 아니라, 지질 및 콜레스테롤의 생체 내 흡수 및 대사를 저해하는 것으로 보고되고 있다. 또한 BSH 효소에 의해 탈결합된 아미노산이 생체 내에서 탄소, 질소 및 에너지원으로 사용될 수 있다(Begley et al., 2005; Ridlon et al., 2006). Cholylglycine hydrolase 효소의 담즙산 가수분해 효능과 관련된 연구는 많이 이루어졌지만(Huijghebaert and Hofmann, 1986; Pedrini et al., 2006), BSH 효소를 이용하여 담즙산을 직접 가수분해하는 연구는 부족한 실정이다(Ji et al., 2016; Rani et al., 2017; Ridlon and Bajaj, 2015; Zhang et al., 2018).
결 론
본 연구는 돼지 부산물에서 획득한 유효성분 및 이들의 성분을 획득하기 위한 연구 방법을 조사하였다. 돼지 부산물에서 획득한 담즙산은 HDCA, CDCA, HCA 및 UDCA와 같은 유효 성분이 주로 확인되었다. 또한, 돼지 부산물에서 획득한 담즙산을 활용하기 위한 방법으로 CDCA 추출 및 UDCA 합성으로 나타났다. 특히, UDCA 합성은 화학적 및 효소적 합성방법으로 구분되었다. 더 나아가 BSH 효소를 활용한 담즙산염의 담즙산 생성 연구는 UDCA 합성 효율을 높여줄 수 있을 것으로 생각된다.
Acknowledgments
This research was supported by the Chung-Ang University Research Grants in 2021.
References
Agellon LB. 2002. Metabolism and function of bile acids. In Biochemistry of lipids, lipoproteins and membranes. Vance DE, Vance JE (ed). Elsevier, Amsterdam, Netherlands. pp 433-448.


Albano E, Bacon BR, Biasi F, Blanck J, Blazovics A, Bors W, Feher E. 2012. Free radicals and the liver. Springer Sci Bus Media. Berlin, Germany.

Alnouti Y, Csanaky IL, Klaassen CD. 2008. Quantitative-profiling of bile acids and their conjugates in mouse liver, bile, plasma, and urine using LC–MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci 873:209-217.


Alvaro D, Cantafora A, Attili AF, Ginanni Corradini S, De Luca C, Minervini G, Di Blase A, Angelico M. 1986. Relationships between bile salts hydrophilicity and phospholipid composition in bile of various animal species. Comp Biochem Physiol 83:551-554.


Bang JS, Lee YJ, Jeong JH, Sohn UD. 2011. Roles of bile acid as an active biological substance. Korean J Clin Pharm 21:49-56.


Baron SF, Franklund CV, Hylemon PB. 1991. Cloning, sequencing, and expression of the gene coding for bile acid 7 alpha-hydroxysteroid dehydrogenase from
Eubacterium sp. strain VPI 12708. J Bacteriol 173:4558-4569.


Batta AK, Aggarwal SK, Mirchandani R, Shefer S, Salen G. 1992. Capillary gas–liquid chromatographic separation of bile alcohols. J Lipid Res 33:1403-1407.


Batta AK, Salen G. 1999. Gas chromatography of bile acids. J Chromatogr B Biomed Sci Appl 723:1-16.


Batta AK, Salen G, Batta M, Earnest D, Alberts D. 1997. Capillary gas–liquid chromatography of acetate–methyl esters of bile acids. J Chromatogr A 766:286-291.


Batta AK, Salen G, Holubec H, Brasitus TA, Alberts D, Earnest DL. 1998. Enrichment of the more hydrophilic bile acid ursodeoxycholic acid in the fecal water-soluble fraction after feeding to rats with colon polyps. Cancer Res 58:1684-1687.

Begley M, Gahan CGM, Hill C. 2005. The interaction between bacteria and bile. FEMS Microbiol Rev 29:625-651.


Begley M, Hill C, Gahan CGM. 2006. Bile salt hydrolase activity in probiotics. Appl Environ Microbiol 72:1729-1738.


Beuers U, Trauner M, Jansen P, Poupon R. 2015. New paradigms in the treatment of hepatic cholestasis: from UDCA to FXR, PXR and beyond. J Hepatol 62:S25-S37.


Braun M, Lünsdorf H, Bückmann AF. 1991. 12
α-Hydroxysteroid dehydrogenase from
Clostridium group P, strain C 48–50: production, purification and characterization. Eur J Biochem 196:439-450.


Burkard I, von Eckardstein A, Rentsch KM. 2005. Differentiated quantification of human bile acids in serum by high-performance liquid chromatography-tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 826:147-159.


Chand D, Avinash VS, Yadav Y, Pundle AV, Suresh CG, Ramasamy S. 2017. Molecular features of bile salt hydrolases and relevance in human health. Biochim Biophys Acta Gen Subj 1861:2981-2991.


Chang HY, Kuo CH, Sun SW. 2003. Determination of ursodeoxycholic acid in pharmaceutical preparations by capillary electrophoresis with indirect UV detection. J Pharm Biomed Anal 32:949-956.


Degirolamo C, Modica S, Palasciano G, Moschetta A. 2011. Bile acids and colon cancer: solving the puzzle with nuclear receptors. Trends Mol Med 17:564-572.


Di Bernardini R, Harnedy P, Bolton D, Kerry J, O’Neill E, Mullen AM, Hayes M. 2011. Antioxidant and antimicrobial peptidic hydrolysates from muscle protein sources and by-products. Food Chem 124:1296-1307.


Dou Q, Jiang Z. 2016. A facile route to ursodeoxycholic acid based on stereocontrolled conversion and aggregation behavior research. Synthesis 48:588-594.


Eggert T, Bakonyi D, Hummel W. 2014. Enzymatic routes for the synthesis of ursodeoxycholic acid. J Biotechnol 191: 11-21.


Feher J. 2012. Quantitative human physiology: an introduction. Academic Press, Amsterdam, Netherlands.

Feng Y, Siu K, Wang N, Ng KM, Tsao SW, Nagamatsu T, Tong Y. 2009. Bear bile: dilemma of traditional medicinal use and animal protection. J Ethnobiol Ethnomed 5:2.


Griffiths WJ, Sjövall J. 2010. Bile acids: analysis in biological fluids and tissues. J Lipid Res 51:23-41.


Grundy SM, Ahrens EH, Miettinen TA. 1965. Quantitative isolation and gas–liquid chromatographic analysis of total fecal bile acids. J Lipid Res 6:397-410.


Hammarsten O. 1902. Untersuchungen über die gallen einiger polarthiere. I. Ueber die Galle des Eisbären. II. Abschnitt. Hoppe Seylers Z Physiol Chem 36:525-555.


Haslewood GAD. 1978. The biological importance of bile salts. North-Holland, Amsterdam, Netherlands.

Hirano S, Masuda N. 1982. Enhancement of the 7
α-dehydroxylase activity of a gram-positive intestinal anaerobe by
Bacteroides and its significance in the 7-dehydroxylation of ursodeoxycholic acid. J Lipid Res 23:1152-1158.


Hofmann AF. 1963. The preparation of chenodeoxycholic acid and its glycine and taurine conjugates. Acta Chem Scand 17:173-186.


Hu X, Feng N, Zhang J. 2018. Study on the factors influencing the extraction of chenodeoxycholic acid from duck bile paste by calcium salt method. J Appl Chem 2018:7253 639.


Huang J, Bathena SPR, Csanaky IL, Alnouti Y. 2011. Simultaneous characterization of bile acids and their sulfate metabolites in mouse liver, plasma, bile, and urine using LC/MS/MS. J Pharm Biomed Anal 55:1111-1119.


Huijghebaert SM, Hofmann AF. 1986. Influence of the amino acid moiety on deconjugation of bile acid amidates by cholylglycine hydrolase or human fecal cultures. J Lipid Res 27:742-752.


Ichida F. 1961. Clinical experience with ursodeoxycholic acid (S-Urso) for chronic hepatitis. Diagn Treat 36:388.

Iwasaki T. 1936. Über die konstitution der urso-desoxycholsäure. Hoppe Seylers Z Physiol Chem 244:181-193.


Jayathilakan K, Sultana K, Radhakrishna K, Bawa AS. 2012. Utilization of byproducts and waste materials from meat, poultry and fish processing industries: a review. J Food Sci Technol 49:278-293.


Ji Q, Tan J, Zhu L, Lou D, Wang B. 2016. Preparing tauroursodeoxycholic acid (TUDCA) using a double-enzyme-coupled system. Biochem Eng J 105:1-9.


Jirsa M, Klinot J, Klinotová E, Ubik K, Kučera K. 1989. Classical bile acids in animals,
β-phocaecholic acid in ducks. Comp Biochem Physiol B Comp Biochem 92: 357-360.


John C, Werner P, Worthmann A, Wegner K, Tödter K, Scheja L, Rohn S, Heeren J, Fischer M. 2014. A liquid chromatography-tandem mass spectrometry-based method for the simultaneous determination of hydroxy sterols and bile acids. J Chromatogr A 1371:184-195.


Jones ML, Chen H, Ouyang W, Metz T, Prakash S. 2003. Method for bile acid determination by high performance liquid chromatography. J Med Sci 23:277-280.

Kanazawa T, Shimazaki A, Sato T, Hoshino T. 1954. Syntheses of ursodesoxycholic acid and its conjugated bile acid. Proc Jpn Acad 30:391-392.


Kasbo J, Saleem M, Perwaiz S, Mignault D, Lamireau T, Tuchweber B, Yousef I. 2002. Biliary, fecal and plasma deoxycholic acid in rabbit, hamster, guinea pig, and rat: comparative study and implication in colon cancer. Biol Pharm Bull 25:1381-1384.


Kibe A, Wake C, Kuramoto T, Hoshita T. 1980. Effect of dietary taurine on bile acid metabolism in guinea pigs. Lipids 15:224-229.


Koopman BJ, Wolthers BG, van der Molen JC, Nagel GT, Waterreus RJ, Oosterhuis HJGH. 1984. Capillary gas chromatographic determinations of urinary bile acids and bile alcohols in CTX patients proving the ineffectivity of ursodeoxycholic acid treatment. Clin Chim Acta 142:103-111.


Kotb MA. 2012. Molecular mechanisms of ursodeoxycholic acid toxicity & side effects: ursodeoxycholic acid freezes regeneration & induces hibernation mode. Int J Mol Sci 13:8882-8914.


Kuramoto T, Miyamoto J, Konishi M, Hoshita T, Masui T, Une M. 2000. Bile acids in porcine fetal bile. Biol Pharm Bull 23:1143-1146.


Lafarga T, Hayes M. 2014. Bioactive peptides from meat muscle and by-products: generation, functionality and application as functional ingredients. Meat Sci 98:227-239.


Lazaridis KN, Gores GJ, Lindor KD. 2001. Ursodeoxycholic acid ‘mechanisms of action and clinical use in hepatobiliary disorders’. J Hepatol 35:134-146.


Lee BG, Kim MD. 2009. Literature study on the efficacy of Fel
Sus scrofa. J Physiol Pathol Korean Med 23:7-14.

Lee GK. 2016. Quantitative profiling of bile acids in rat bile using ultrahigh performance liquid chromatography orbitrap mass spetrometry: Alteration of the bile acid composition with aging. J Chromatogr B 1031:37-49.


Lee JY. 1995. Studies on analysis of composition of bear bile and human bille. M.S. thesis, Ewha Womans Univ. Seoul, Korea.

Lee KT. 2001. Special topic: Drug therapy for pancreatobiliary disease. Korean J Pancreas Biliary tract 6:93-99.

Lundell K, Wikvall K. 2008. Species-specific and age-dependent bile acid composition: aspects on CYP8B and CYP4A subfamilies in bile acid biosynthesis. Curr Drug Metab 9:323-331.


Ma X, Cao X. 2014. Separation of ursodeoxycholic acid by silylation crystallization. Bioresour Bioprocess 1:5.


MacDonald IA, Rochon YP, Hutchison DM, Holdeman LV. 1982. Formation of ursodeoxycholic acid from chenodeoxycholic acid by a 7 beta-hydroxysteroid dehydrogenase-elaborating
Eubacterium aerofaciens strain cocultured with 7 alpha-hydroxysteroid dehydrogenase-elaborating organisms. Appl Environ Microbiol 44:1187-1195.


Makino I, Shinozaki K, Yoshino K, Nakagawa S. 1975. Dissolution of cholesterol gallstones by long-term administration of ursodeoxycholic acid. Nihon Shokakibyo Gakkai zasshi 72:690-702.

Moghimipour E, Ameri A, Handali S. 2015. Absorption-enhancing effects of bile salts. Molecules 20:14451-14473.


Mora L, Reig M, Toldrá F. 2014. Bioactive peptides generated from meat industry by-products. Food Res Int 65:344-349.


Mukherjee J, Pal TK. 2011. Development and validation of RP-HPLC method to determine ursodeoxycholic acid in pharmaceutical dosage forms. Int J Pharm Sci Res 2:73-78.

Nobilis M, Pour M, Kuneš J, Kopecký J, Květina J, Svoboda Z, Sládková K, Vortel J. 2001. High-performance liquid chromatographic determination of ursodeoxycholic acid after solid phase extraction of blood serum and detection-oriented derivatization. J Pharm Biomed Anal 24:937-946.


Oomen AG, Rompelberg CJM, Van de Kamp E, Pereboom DPKH, De Zwart LL, Sips AJAM. 2004. Effect of bile type on the bioaccessibility of soil contaminants in an
in vitro digestion model. Arch Environ Contam Toxicol 46:183-188.


Pedrini P, Andreotti E, Guerrini A, Dean M, Fantin G, Giovannini PP. 2006.
Xanthomonas maltophilia CBS 897.97 as a source of new 7
β- and 7
α-hydroxysteroid dehydrogenases and cholylglycine hydrolase: improved biotransformations of bile acids. Steroids 71:189-198.


Rani RP, Anandharaj M, Ravindran AD. 2017. Characterization of bile salt hydrolase from
Lactobacillus gasseri FR4 and demonstration of its substrate specificity and inhibitory mechanism using molecular docking analysis. Front Microbiol 8:1004.


Ridlon JM, Bajaj JS. 2015. The human gut sterolbiome: bile acid-microbiome endocrine aspects and therapeutics. Acta Pharm Sin B 5:99-105.


Ridlon JM, Kang DJ, Hylemon PB. 2006. Bile salt biotransformations by human intestinal bacteria. J Lipid Res 47:241-259.


Sawada H, Kulprecha S, Nilubol N, Yoshida T, Kinoshita S, Taguchi H. 1982. Microbial production of ursodeoxycholic acid from lithocholic acid by
Fusarium equiseti M41. Appl Environ Microbiol 44:1249-1252.


Scalia S. 1995. Bile acid separation. J Chromatogr B Biomed Sci Appl 671:299-317.


Seo MJ, Lee YS, Lee JW, An HJ, Ryu HK, Kim HK, Hong SH. 2016. Comparative analysis of the physicochemical characteristics of bear, pig, and cow biles. Food Eng Prog 20:349-356.


Seol SY. 2002. Clinical lecture: Drug therapy for biliary tract disease. Korean J Pancreas Biliary tract 7:3-10.

Setchell KDR, Lawson AM, Tanida N, Sjövall J. 1983. General methods for the analysis of metabolic profiles of bile acids and related compounds in feces. J Lipid Res 24:1085-1100.


Setchell KDR, Matsui A. 1983. Serum bile acid analysis. Clin Chim Acta 127:1-17.


Setchell KDR, Worthington J. 1982. A rapid method for the quantitative extraction of bile acids and their conjugates from serum using commercially available reverse-phase octadecylsilane bonded silica cartridges. Clin Chim Acta 125:135-144.


Sharma KR. 2012. Review on bile acid analysis. Int J Pharm Biomed Sci 3:28-34.

Sharp HL, Peller J, Carey JB Jr, Krivit W. 1971. Primary and secondary bile acids in meconium. Pediatr Res 5:274-279.


Shneider BL. 2001. Intestinal bile acid transport: biology, physiology, and pathophysiology. J Pediatr Gastroenterol Nutr 32:407-417.


Shoda M. 1927. Über die ursodesoxycholsäure aus bärengallen und ihre physiologische wirkung. J Biochem 7:505-517.


Stamp D, Jenkins G. 2008. An overview of bile-acid synthesis, chemistry and function. In Bile acids: toxicology and bioactivity. Jenkins G, Hardie LJ (ed). Royal Society of Chemistry, Cambridge, UK. pp 1-13.


Street JM, Trafford DJH, Makin HLJ. 1985. Extraction and fractionation of bile acids and their conjugates using pre-packed microparticulate silica cartridges (sep-pak sil
® and bond-elut
® C18). J Chromatogr B Biomed Sci Appl 343:259-270.


Street JM, Trafford DJH, Makin HLJ. 1986. Capillary gas-liquid chromatography of glycine-conjugated bile acids without prior hydrolysis. J Lipid Res 27:208-214.


Suzuki Y, Kaneko R, Nomura M, Naito H, Kitamori K, Nakajima T, Ishii A. 2013. Simple and rapid quantitation of 21 bile acids in rat serum and liver by UPLC-MS-MS: effect of high fat diet on glycine conjugates of rat bile acids. Nagoya J Med Sci 75:57-71.

Tessier E, Neirinck L, Zhu Z. 2003. High-performance liquid chromatographic mass spectrometric method for the determination of ursodeoxycholic acid and its glycine and taurine conjugates in human plasma. J Chromatogr B Analyt Technol Biomed Life Sci 798:295-302.


Thomas C, Pellicciari R, Pruzanski M, Auwerx J, Schoonjans K. 2008. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov 7:678-693.


Tian H, Zhao H, Cao X. 2013. Catalytic transfer hydrogenation of 7-ketolithocholic acid to ursodeoxycholic acid with Raney nickel. J Ind Eng Chem 19:606-613.


Tint GS, Bullock J, Batta AK, Shefer S, Salen G. 1986. Ursodeoxycholic acid, 7-ketolithocholic acid, and chenodeoxycholic acid are primary bile acids of the nutria (
Myocastor coypus). Gastroenterology 90:702-709.


Toldrá F, Aristoy MC, Mora L, Reig M. 2012. Innovations in value-addition of edible meat by-products. Meat Sci 92: 290-296.


Toldrá F, Mora L, Reig M. 2016. New insights into meat by-product utilization. Meat Sci 120:54-59.


Tonin F, Arends IWCE. 2018. Latest development in the synthesis of ursodeoxycholic acid (UDCA): a critical review. Beilstein J Org Chem 14:470-483.


Tsai SJJ, Zhong YS, Weng JF, Huang HH, Hsieh PY. 2011. Determination of bile acids in pig liver, pig kidney and bovine liver by gas chromatography-chemical ionization tandem mass spectrometry with total ion chromatograms and extraction ion chromatograms. J Chromatogr A 1218: 524-533.


Wan J, He J, Cao X. 2012. A novel process for preparing pure chenodeoxycholic acid from poultry bile. J Ind Eng Chem 18:65-71.


Wang DQH, Carey MC. 2014. Therapeutic uses of animal biles in traditional Chinese medicine: an ethnopharmacological, biophysical chemical and medicinal review. World J Gastroenterol 20:9952-9975.


Wieland HO. 1966. The chemistry of the bile acids. Nobel Lectures, Chem 1922, 1941:105-121.

Yang YJ, Lee SH, Kim HJ, Chung BC. 1998. Simultaneous determination of cholesterol, bile acids and sterols in human bile juices and gallstones using GC/MS. J Korean Chem Soc 42:266-276.

Yoon JW. 2004. Clinical challenges encountered in liver disease care 1: Cholestatic liver disease. Clin Mol Hepatol 10:36-53.

Yuan X, Ma X, Cao X. 2014. Preparation of ursodeoxycholic acid by direct electro-reduction of 7-ketolithocholic acid. Korean J Chem Eng 31:1276-1280.


Zhang L, Wu W, Lee YK, Xie J, Zhang H. 2018. Spatial heterogeneity and co-occurrence of mucosal and luminal microbiome across swine intestinal tract. Front Microbiol 9:48.


Zhao H, Tian H, Jin Y, Cao X. 2010. Synthesis of 7-ketolithocholic acid via indirect electrooxidation of chenodeoxycholic acid. J Appl Electrochem 40:1307-1316.


Zheng MM, Chen FF, Li H, Li CX, Xu JH. 2018. Continuous production of ursodeoxycholic acid by using two cascade reactors with co-immobilized enzymes. ChembioChem 19:347-353.


Zhou WS, Wang ZQ, Jiang B. 1990. Stereocontrolled convertsion of hyodeoxycholic acid into chenodeoxycholic acid and ursodeoxycholic acid. J Chem Soc Perkin Trans 1:1-3.


Ziegler P, Attwell MC, Massiah TF, Vergottini RA. 1980. Chenodeoxycholic acid recovery process. US Patent 4,186,143.

Ziyun X, Junfen W, Shuang L, Xuejun C. 2008. Separation of ursodeoxycholic acid from its isomeric mixture using core– shell molecular imprinting polymer. Biochem Eng J 41: 280-287.